Содержание
Гемоглобин в крови у ребенка в Приморском районе СПб
Гемоглобин – это белок, доставляющий кислород из легких по всем тканям и системам, а также транспортирует углекислоту обратно. Гемоглобин содержится в эритроцитах, он делает их красными.
Анализ на гемоглобин у ребенка – это важное исследование, которое позволяет выявить нарушения в работе организма на ранних стадиях.
Как проводится анализ на гемоглобин
- Кровь берется из вены или из пальца.
- Перед сдачей анализа нужно соблюдать диету (исключить жареные и копченые блюда, сладкое).
- Кровь сдается натощак, утром.
- Если ребенок грудной, то взятие крови проводится не раньше, чем через 2 часа после кормления.
Предупредите врача, если ваш ребенок принимает какие-нибудь лекарства.
Норма гемоглобина в крови для детей разного возраста отличается
Анализ на гемоглобин в клинике «Основа Дети»
Сдайте анализ в современной лаборатории клиники «Основа Дети» и получите высокоточный результат. Мы работаем в Приморском районе Санкт-Петербурга, а прием ведем по записи, без очередей. Детский центр «Основа» многопрофильный, потому здесь вы сможете не только сдать анализы, но и получить консультацию опытных специалистов разной направленности. Для забора крови медсестра может выехать к вам дом, чтобы сэкономить время и не подвергать опасности лишний раз ребенка.
Мы работаем в Приморском районе Санкт-Петербурга, а прием ведем по записи, без очередей. Детский центр «Основа» многопрофильный, потому здесь вы сможете не только сдать анализы, но и получить консультацию опытных специалистов разной направленности. Для забора крови медсестра может выехать к вам дом, чтобы сэкономить время и не подвергать опасности лишний раз ребенка.
Причины повышенного гемоглобина:
- большие кровопотери из-за травм, ожогов;
- обезвоживание организма из-за сахарного диабета, перенесенных инфекций;
- заболевания крови – повышенная выработка эритроцитов;
- сердечная недостаточность;
- проблемы с дыхательной системой, влияющие на недостаток кислорода;
- онкологические заболевания;
- проблемы с почками;
- нахождение в высокогорных местностях;
- генетические нарушения.
Чтобы понизить уровень гемоглобина, назначаются специальные препараты для разжижжения крови, прописывается специальная диета.
Причины пониженного гемоглобина:
- заболевания ЖКТ;
- болезни крови;
- инфекция;
- онкология;
- аутоиммунные нарушения;
- недостаток витаминов группы В12.
Пониженный гемоглобин в крови еще называют анемией или малокровием. У грудничков пониженные показатели гемоглобина могут требовать переливания крови.
При повышенном гемоглобине из рациона ребенка исключаются продукты, богатые железом. При пониженном гемоглобине в рацион добавляют продукты, богатые железом. Дополнительным источником железа может быть гематоген.
Что влияет на поддержание гемоглобина в норме:
- сбалансированное питание;
- прогулки на свежем воздухе;
- физическая активность.
Как часто нужно сдавать кров на гемоглобин
Рекомендуется сдавать кровь на гемоглобин детям не реже 1 раза в год. Грудничкам анализ делают в 3,6 и 12 месяцев.
Доверяйте здоровье своего ребенка профессионалам и современному оборудованию, передовым лабораториям. У нас вы сможете не только сдать анализ на гемоглобин у ребенка, но и получить консультации врача, он назначит эффективное лечение или коррекцию. Запишитесь на анализ у администратора.
У нас вы сможете не только сдать анализ на гемоглобин у ребенка, но и получить консультации врача, он назначит эффективное лечение или коррекцию. Запишитесь на анализ у администратора.
Нормы гемоглобина у детей по возрасту. Таблицы
Нормы гемоглобина у детей и взрослых, и даже у детей разного возраста значительно различаются. Чтобы результаты анализа не напугали, стоит знать эту разницу.
Источник: Fotolia
Сложный железосодержащий белок крови гемоглобин содержится в красных кровяных тельцах эритроцитах и основная его функция – транспортировка кислорода ко всем органам человеческого организма. В первые две недели жизни младенца уровень гемоглобина в его крови заметно превышает норму у взрослого человека, но затем немного снижается и к 1-2 месяцам количество этого белка в крови малыша может напугать, если не вникать в особенности развития младенца.
Источник: Shutterstock
После 2-месячного возраста уровень гемоглобина в эритроцитах постепенно повышается, вплоть до пубертата, когда нормы этого белка у мальчиков и девочек начинают различаться – после 12-13 лет у мальчиков гемоглобина содержится больше чем у девочек. Стоит так же заметить, что в разных лабораториях нормы могут немного различаться, так что, если вас что-то беспокоит, имеет смыл анализ пересдать в другой лаборатории. И, конечно, не делать самостоятельных выводов, не ставить ребенку и диагноз и уж точно, не назначать лечение. Все это должен сделать врач.
Стоит так же заметить, что в разных лабораториях нормы могут немного различаться, так что, если вас что-то беспокоит, имеет смыл анализ пересдать в другой лаборатории. И, конечно, не делать самостоятельных выводов, не ставить ребенку и диагноз и уж точно, не назначать лечение. Все это должен сделать врач.
Нормы гемоглобина у детей. Таблица
| Возраст | Гемоглобин, г/л |
| < 14 дней | 134-198 |
| 14 дней – 1 мес. | 107-171 |
| 1-2 мес. | 94-130 |
| 2-4 мес. | 103-141 |
| 4-6 мес. | 111-141 |
| 6-9 мес. | 110-140 |
| 9-12 мес. | 113-141 |
| 1-5 лет | 110-140 |
| 5-10 лет | 115-145 |
| 10-12 лет | 120-150 |
| 12-15 лет (мальчики) | 120-160 |
| 12-15 лет (девочки) | 115-150 |
| 15-18 лет (мальчики) | 117-166 |
| 15-18 лет (девочки) | 117-153 |
Чем опасен дефицит гемоглобина
Низкий уровень гемоглобина чреват недостатком снабжения кислородом всех органов, в том числе головного мозга. Дефицит гемоглобина приводит к тяжелому состоянию под названием железодефицитная анемия, лечить которое очень непросто. Причин такого состояния может быть множество, но чаще всего это несбалансированное питание (в том числа мамы, кормящей ребенка грудью). Для того, чтобы не допустить снижение уровня гемоглобина у ребенка, а тем более, развития анемии, он должен получать с пищей не только достаточное количество железа (желательно гемового), но и вещества, без которых оно не усваивается — витамин В12, аскорбиновая и фолиевая кислота, витамин А.
Дефицит гемоглобина приводит к тяжелому состоянию под названием железодефицитная анемия, лечить которое очень непросто. Причин такого состояния может быть множество, но чаще всего это несбалансированное питание (в том числа мамы, кормящей ребенка грудью). Для того, чтобы не допустить снижение уровня гемоглобина у ребенка, а тем более, развития анемии, он должен получать с пищей не только достаточное количество железа (желательно гемового), но и вещества, без которых оно не усваивается — витамин В12, аскорбиновая и фолиевая кислота, витамин А.
Источник: who.int
Повышенный гемоглобин у ребенка
Гемоглобин выше номы так же не слишком хороший знак, хотя встречается значительно реже. Чаще всего такое изменение крови свидетельствует об обезвоживании ребенка, но может быть спровоцировано и более серьезным причинами, такими как заболевания крови, онкологические заболевания, фиброз легких, заболевания почек и другими.
Важно: никогда не ставьте диагноз ребенку увидев его анализы. Обязательно покажите их врачу.
Обязательно покажите их врачу.
Мнение редакции может не совпадать с мнением автора статьи.
Использование фото: П.4 ст.21 ЗУ «Об авторских и смежных правах — «Воспроизведение с целью освещения текущих событий средствами фотографии или кинематографии, публичное сообщение или сообщение произведений, увиденных или услышанных во время таких событий, в объеме, оправданном информационной целью.»
Анемия при сердечно-сосудистых заболеваниях
С.П. Сидорук, Е.Б. Петрова, Н.П. Митьковская
Госпиталь, Аль-Ахса, Саудовская Аравия, УО «Белорусский государственный медицинский университет»
Анемия часто встречается у пациентов с патологией сердечно-сосудистой системы: может наблюдаться у трети пациентов с застойной сердечной недостаточностью и у 10-20% пациентов с ишемической болезнью сердца (ИБС). Причины анемии при болезнях сердца многофакторны и могут включать хроническое воспаление, абсолютный или функциональный дефицит железа, недостаточную выработку и активность эритропоэтина, гемоделюцию, нарушения функции почек. Гемодинамические и негемодинамические изменения вследствие анемии при наличии сопутствующих хронических болезней сердца вносят вклад в увеличение частоты сердечно-сосудистых осложнений. Анемия является независимым фактором риска неблагоприятного исхода при сердечно-сосудистых заболеваниях и, вероятно, является как медиатором, так и маркером неблагоприятного прогноза. Лечение анемии у пациентов с сердечно-сосудистыми заболеваниями может включать эритропоэтины, переливание крови и прием препаратов железа.
Гемодинамические и негемодинамические изменения вследствие анемии при наличии сопутствующих хронических болезней сердца вносят вклад в увеличение частоты сердечно-сосудистых осложнений. Анемия является независимым фактором риска неблагоприятного исхода при сердечно-сосудистых заболеваниях и, вероятно, является как медиатором, так и маркером неблагоприятного прогноза. Лечение анемии у пациентов с сердечно-сосудистыми заболеваниями может включать эритропоэтины, переливание крови и прием препаратов железа.
ключевые слова: анемия, сердечно-сосудистые заболевания, ишемическая болезнь сердца, артериальная гипертензия, дефицит железа, карбоскимальтоза
для цитирования: Сидорук С.П., Петрова Е.Б., Митьковская Н.П. Анемия при сердечно-сосудистых заболеваниях. Неотложная кардиология и кардиооваскулярные риски, 2017, Т. 1, №1, С. 38-45.
Введение
Сердечно-сосудистые заболевания являются основной причиной смерти во всем мире. Многие пациенты с сердечно-сосудистой патологией страдают анемией в результате острых или хронических сопутствующих состояний. Согласно критериям Всемирной организации здравоохранения термин «анемия» раскрывается как состояние, при котором наблюдается согласно гендерной принадлежности снижение концентрации гемоглобина в крови: у женщин — менее 120 г/л и менее 130 г/л у мужчин. Анемия является важной проблемой практического здравоохранения, так как влияет на качество жизни, смертность и является частой причиной обращения к врачу.
Многие пациенты с сердечно-сосудистой патологией страдают анемией в результате острых или хронических сопутствующих состояний. Согласно критериям Всемирной организации здравоохранения термин «анемия» раскрывается как состояние, при котором наблюдается согласно гендерной принадлежности снижение концентрации гемоглобина в крови: у женщин — менее 120 г/л и менее 130 г/л у мужчин. Анемия является важной проблемой практического здравоохранения, так как влияет на качество жизни, смертность и является частой причиной обращения к врачу.
Во всем мире анемией страдают 1,62 миллиарда людей, что составляет 24,8% от общего населения планеты. Наиболее часто анемии подвержены дети дошкольного возраста (47%), а реже всего – мужчины (12,7%). В половине случаев причиной анемии является дефицит железа [1]. Недостаток железа не только нарушает образование эритроцитов, но и ухудшает клеточные функции, связанные с мышечным метаболизмом, влияет на функцию митохондрий, нейротрансмиттеров, синтез ДНК и иммунную систему [2].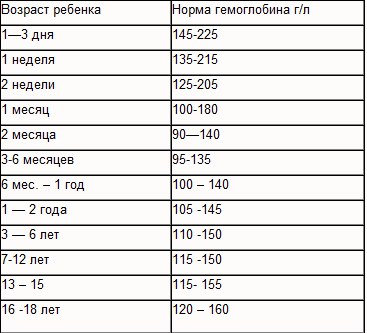 Частота анемии увеличивается с возрастом, что делает ее частым спутником сердечно-сосудистых катастроф. Анализ литературных источников продемонстрировал, что анемия является независимым предиктором кардиоваскулярных заболеваний и неблагоприятных исходов [3].
Частота анемии увеличивается с возрастом, что делает ее частым спутником сердечно-сосудистых катастроф. Анализ литературных источников продемонстрировал, что анемия является независимым предиктором кардиоваскулярных заболеваний и неблагоприятных исходов [3].
Влияние анемии на сердечно-сосудистую систему
Для оценки патологического влияния снижения концентрации уровня гемоглобина в крови на кардиоваскулярные риски необходимо рассмотреть физиологическую реакцию организма на анемию. Основными факторами, ответственными за газообмен, выступают: интенсивность кровотока и его распределение, потребление кислорода клетками, оксигенация крови. Гипоксия при анемии компенсируется каскадом гемодинамических и гемодинамически не ассоциированных механизмов, таких как активация продукции эритропоэтина, повышение тканевой утилизации кислорода. Реализация основных гемодинамических факторов достигается путем повышения контрактильной способности миокарда, уменьшения постнагрузки, увеличения преднагрузки, реализацией положительного ино- и хронотропных эффектов. Повышение продукции оксида азота, индуцированная гипоксией вазодилатация и снижение вязкости крови являются причиной уменьшения сосудистого сопротивления и приводят к снижению постнагрузки. Хроническая анемия стимулирует ангиогенез и образование новых мелких сосудов. Развитие коллатералей и микроциркуляторного русла способствует снижению постнаргузки. Повышение венозного возврата (преднагрузки) и кровенаполнения левого желудочка способствуют увеличению конечного диастолического объема и фракции выброса левого желудочка. При кратковременной анемии эти изменения обратимы, при хронизации процесса — приводят к ремоделированию с формированием эссентрической гипертрофии миокарда левого желудочка, как и при других формах объёмных перегрузок.
Повышение продукции оксида азота, индуцированная гипоксией вазодилатация и снижение вязкости крови являются причиной уменьшения сосудистого сопротивления и приводят к снижению постнагрузки. Хроническая анемия стимулирует ангиогенез и образование новых мелких сосудов. Развитие коллатералей и микроциркуляторного русла способствует снижению постнаргузки. Повышение венозного возврата (преднагрузки) и кровенаполнения левого желудочка способствуют увеличению конечного диастолического объема и фракции выброса левого желудочка. При кратковременной анемии эти изменения обратимы, при хронизации процесса — приводят к ремоделированию с формированием эссентрической гипертрофии миокарда левого желудочка, как и при других формах объёмных перегрузок.
Увеличение сердечного выброса в свою очередь способствует развитию артериального ремоделирования центральных сосудов эластического типа, таких как аорта и общие сонные артерии, за счёт увеличения просвета и компенсаторного утолщения комплекса интима-медии. Как следствие — повышение систолического давления и инерции, большая масса крови попадает в дилатированную артериальную систему. Активация симпатической нервной системы усиливает контрактильность левого желудочка и увеличивает частоту сердечных сокращений. В присутствии хронических заболеваний сердца эти дополнительные эффекты, опосредованные анемией, способствуют увеличению частоты сердечно-сосудистых осложнений [4].
Как следствие — повышение систолического давления и инерции, большая масса крови попадает в дилатированную артериальную систему. Активация симпатической нервной системы усиливает контрактильность левого желудочка и увеличивает частоту сердечных сокращений. В присутствии хронических заболеваний сердца эти дополнительные эффекты, опосредованные анемией, способствуют увеличению частоты сердечно-сосудистых осложнений [4].
Анемия при артериальной гипертензии
Нормохромная анемия – нередкая находка у пациентов, страдающих артериальной гипертензией (АГ), и чаще встречается при неконтролируемой гипертензии. Низкий уровень гемоглобина ассоциируется с плохим контролем артериального давления и является индикатором повышенного сердечно-сосудистого риска [5]. Согласно литературным данным, пациенты, страдающие АГ с сопутствующей анемией, имеют более высокие значения среднесуточного, ночного и недостаточное снижение ночного систолического артериального давления по сравнению с теми, у которых наблюдался нормальный уровень гемоглобина. У пациентов с анемией также прослеживается тенденция к увеличению среднесуточных значений диастолического артериального давления [6]. У пациентов с изолированной систолической гипертензией и гипертрофией левого желудочка с сопутствующим снижением уровня гемоглобина наблюдается увеличение сердечно-сосудистой смертности и частоты развитий острых нарушений мозгового кровообращения [7].
У пациентов с анемией также прослеживается тенденция к увеличению среднесуточных значений диастолического артериального давления [6]. У пациентов с изолированной систолической гипертензией и гипертрофией левого желудочка с сопутствующим снижением уровня гемоглобина наблюдается увеличение сердечно-сосудистой смертности и частоты развитий острых нарушений мозгового кровообращения [7].
Изменение электрокардиограммы при анемии
Электрокардиографические реполяризационные изменения (депрессия сегмента ST, инверсия зубца Т, удлинение интервала QT) часто встречаются у пациентов с анемией как в покое, так и при нагрузке [8]. Было обнаружено, что уровень гемоглобина сильно коррелирует с изменениями на электрокардиограмме [9].
Удлинение интервала QT является предиктором желудочковой аритмии и внезапной смерти. Гипоксия и нарушение доставки кислорода у пациентов с анемией может быть причиной нарушения реполяризации миокарда. Согласно проведенным исследованиям, анемия, макроцитоз и анизоцитоз коррелируют с удлинением интервала QT у пациентов с артериальной гипертензией и могут учитываться в оценке риска внезапной смерти [10]. Низкий уровень железа в остальном у практически здоровых детей отрицательно коррелирует с интервалами QT и QTс и может указывать на дополнительный риск развития аритмии [11].
Низкий уровень железа в остальном у практически здоровых детей отрицательно коррелирует с интервалами QT и QTс и может указывать на дополнительный риск развития аритмии [11].
Mehta и соавт. продемонстрировал значимую и воспроизводимую депрессию сегмента ST у пациентов с железно-дефицитной анемией во время нагрузочных тестов. Эти электрофизиологические изменения исчезали после лечения препаратами железа ещё до нормализации уровня гемоглобина, что может объясняться эффектом железа на тканевом уровне [12].
Анемия при ишемической болезни сердца
Ишемия миокарда определяется степенью выраженности несоответствия потребности кардиомиоцитов в кислороде и возможностями его доставки. Определяющими факторами, влияющими на заинтересованность миокарда в кислороде, являются: частота сердечных сокращений, контрактильность миокарда и напряжение стенки сердца. Факторами, определяющими доставку кислорода к сердцу, являются содержание кислорода в крови и интенсивность коронарного кровотока. Увеличение доставки кислорода к миокарду в ответ на увеличение потребления происходит путем уменьшения сопротивления коронарного русла. Экстракция кислорода кардиомиоцитами даже в покое составляет около 90% [13]. У пациентов без коронарной патологии даже значительное снижение содержания кислорода в коронарном кровотоке может компенсироваться за счёт периферической вазодилатации. При коронарном стенозе этот механизм имеет ограниченные возможности. Согласно данным литературы, у животных с анемией при остром инфаркте миокарда увеличивалась зона инфарцирования, снижалась насосная функция сердца и выживаемость. Переливание крови животным с анемией до уровня гемоглобина 100 г/л уменьшало зону инфаркта и улучшало контрактильную возможность миокарда. Вместе с тем, переливание крови до уровня гемоглобина 120 г/л было связано с увеличением зоны инфаркта [14].
Увеличение доставки кислорода к миокарду в ответ на увеличение потребления происходит путем уменьшения сопротивления коронарного русла. Экстракция кислорода кардиомиоцитами даже в покое составляет около 90% [13]. У пациентов без коронарной патологии даже значительное снижение содержания кислорода в коронарном кровотоке может компенсироваться за счёт периферической вазодилатации. При коронарном стенозе этот механизм имеет ограниченные возможности. Согласно данным литературы, у животных с анемией при остром инфаркте миокарда увеличивалась зона инфарцирования, снижалась насосная функция сердца и выживаемость. Переливание крови животным с анемией до уровня гемоглобина 100 г/л уменьшало зону инфаркта и улучшало контрактильную возможность миокарда. Вместе с тем, переливание крови до уровня гемоглобина 120 г/л было связано с увеличением зоны инфаркта [14].
Sabatine et al. обнаружил U-образную зависимость клинических событий при остром коронарном синдроме к 30-му дню: у пациентов с инфарктом миокарда с подъемом сегмента ST наблюдалось увеличение смертности при уровне гемоглобина ниже 140 г/л и выше 170 г/л, в то время как у пациентов с инфарктом миокарда без подъема сегмента ST смертность, размер инфаркта и ишемии увеличивались при уровне гемоглобина менее 110 г/л и более 160 г/л [15].
Анемия является весомым фактором риска при ишемической болезни сердца (ИБС). Пациенты с ишемической болезнью сердца и сопутствующей анемией имеют более выраженную степень коронарной патологии. Согласно ряду публикаций, у пациентов с ИБС и анемией уровень гемоглобина, сывороточного железа и общая железосвязывающая способность крови отрицательно коррелируют с тяжестью коронарной патологии [16]. У пациентов с ишемической болезнью сердца и сопутствующей анемией наблюдается увеличение смертности по сравнению с категорией лиц с изолированной ИБС, а анемия выступает независимым предиктором возникновения острого ишемического повреждения миокарда [17].
Исследование Ferreira и соавт. выявило, что уровень гемоглобина менее 108 г/л являлся одним из наиболее сильных независимых предикторов смертности к концу первого года при остром коронарном синдроме. Он предложил включить уровень гемоглобина в оценку риска пациентов, госпитализированных с острым коронарным синдромом, так как это является доступным параметром и систематически оценивается при госпитализации [18].
В исследовании Cadilac анемия часто встречалась у пациентов, направленных на первичную ангиопластику по поводу острого инфаркта миокарда. Была продемонстрирована сильная корреляционная связь между снижением уровня гемоглобина и развитием неблагоприятных исходов, увеличением смертности. Сделан вывод, что анемия выступала независимым предиктором госпитальной и общей смертности к концу первого года постинфарктного периода [19]. Тяжелая анемия может приводить к дисбалансу между доставкой и потреблением кислорода в миокарде даже при отсутствии гемодинамически значимого коронарного стенозирования. Bailey с соавт. описал пример развития острого коронарного синдрома с подъемом сегмента ST у пациента с тяжелой анемией в отсутствии ангиографически значимого коронарного стеноза, тромбоза или спазма [20].
Таким образом, причины неблагоприятных исходов у пациентов с анемией и коронарной патологией многочисленны. Уменьшение кислородной емкости крови, а также активация симпатической нервной системы могут повышать потребность миокарда в кислороде и усугублять ишемию.
Анемия при сердечной недостаточности
Анемия – частое сопутствующее патологическое состояние при сердечной недостаточности (СН). У пациентов с сердечной недостаточностью и сопутствующей анемией прослеживается следующая тенденция: у них более выражены симптомы левожелудочковой недостаточности, выше частота госпитализаций по поводу декомпенсации хронической сердечной недостаточности (ХСН), среди них чаще встречаются женщины, пациенты представлены старшей возрастной группой, у них чаще диагностируется сахарный диабет, сопутствующая почечная недостаточность и артериальная гипертензия [21]. Анемия – мощный предиктор повторных госпитализаций и низкой выживаемости при хронической сердечной недостаточности [22]. Частота встречаемости анемии возрастает при увеличении степени тяжести сердечной недостаточности и может достигать 79.1% у пациентов с IV функциональным классом СН по классификации Нью-Йоркской Ассоциации Сердца [23].
Этиология анемии при сердечной недостаточности является многофакторной, и множество механизмов ответственно за это состояние. Увеличение системного воспаления, нейрогуморальная активация, нарушение питания, дисфункция почек, снижение ответа костного мозга на запрос и эффект приема ряда лекарственных средств вносят вклад в ее развитие. Увеличение циркулирующих провоспалительных цитокинов при СН вызывает нарушение мобилизации железа, недостаточную продукцию эритропоэтина в ответ на активацию ренин-ангиотензин-альдостероновой системы и снижение почечного кровотока, снижение функции костного мозга. Использование ингибиторов ангиотензин-превращающего фермента может дополнительно уменьшать секрецию эритропоэтина. Нарушение питания вследствие отсутствия аппетита, желудочно-кишечная мальабсорбция, прием аспирина могут усугублять железодефицитную анемию. Гемоделюция также вносит дополнительный вклад в становление анемии [24].
Увеличение системного воспаления, нейрогуморальная активация, нарушение питания, дисфункция почек, снижение ответа костного мозга на запрос и эффект приема ряда лекарственных средств вносят вклад в ее развитие. Увеличение циркулирующих провоспалительных цитокинов при СН вызывает нарушение мобилизации железа, недостаточную продукцию эритропоэтина в ответ на активацию ренин-ангиотензин-альдостероновой системы и снижение почечного кровотока, снижение функции костного мозга. Использование ингибиторов ангиотензин-превращающего фермента может дополнительно уменьшать секрецию эритропоэтина. Нарушение питания вследствие отсутствия аппетита, желудочно-кишечная мальабсорбция, прием аспирина могут усугублять железодефицитную анемию. Гемоделюция также вносит дополнительный вклад в становление анемии [24].
Дефицит железа
Дефицит железа (ДЖ) – наиболее частая причина анемии у пациентов с сердечной недостаточностью [25,26]. Дефицит железа может наблюдаться и при нормальном уровне гемоглобина, а железодефицитное состояние без анемии выявляется у 46% пациентов со стабильной сердечной недостаточностью [27]. ДЖ может быть представлен в абсолютной и функциональной формах. При абсолютном дефиците железа наступает истощение его запасов в организме, а железодефицитная анемия может рассматриваться как конечная стадия этого истощения. Функциональный дефицит железа связан с неадекватным его высвобождением из депо в ответ на потребности костного мозга и встречается при многих острых и хронических воспалительных состояниях. Дефицит железа ассоциируется с прогрессированием симптомов сердечной недостаточности, снижением качества жизни, увеличением смертности и госпитализаций [28-30].
ДЖ может быть представлен в абсолютной и функциональной формах. При абсолютном дефиците железа наступает истощение его запасов в организме, а железодефицитная анемия может рассматриваться как конечная стадия этого истощения. Функциональный дефицит железа связан с неадекватным его высвобождением из депо в ответ на потребности костного мозга и встречается при многих острых и хронических воспалительных состояниях. Дефицит железа ассоциируется с прогрессированием симптомов сердечной недостаточности, снижением качества жизни, увеличением смертности и госпитализаций [28-30].
Активация симпатической и ренин-ангиотензин-альдостероновой систем, хроническое воспаление, абсолютный и функциональный дефицит железа, нарушение образования и активности эритропоэтина, гемоделюция, почечная дисфункция ухудшают прогноз у пациентов с сердечной недостаточностью. Вероятно, анемия является как медиатором, так и маркером неблагоприятного прогноза у пациентов с сердечной недостаточностью.
Лечение анемии у пациентов с заболеваниями сердца
Лечение анемии при сердечной недостаточности и ишемической болезни сердца может включать прием эритропоэтинов, при наличии железодефицитных состояний с анемией или без нее — терапию препаратами железа, при тяжелом течении — переливание эритроцитарной массы.
Шестнадцать рандомизированных контролируемых исследований оценивало эффект эритропоэтинов у пациентов с сердечной недостаточностью. Большинство этих исследований включало пациентов с систолической сердечной недостаточностью. Полученные данные с умеренной степенью доказательности продемонстрировали отсутствие улучшения качества жизни и переносимости физических нагрузок при лечении эритропоэтинами. В то же время данные с высокой степенью доказательности продемонстрировали отсутствие снижения смертности при лечении эритропоэтинами. Среди серьезных побочных эффектов, связанных с их применением, выделили развитие сосудистых тромбозов [31].
Несмотря на то, что анемия часто встречается у пациентов с хронической сердечной недостаточностью и ишемической болезнью сердца, лечение эритропоэтинами не уменьшало смертность, риск кардиоваскулярных событий или частоту госпитализаций [31]. Американский Колледж Врачей не рекомендует использование эритропоэтинов у пациентов с сердечной недостаточностью или коронарной болезнью сердца при незначительной или умеренной степени тяжести анемии [31].
Переливание крови было предложено для коррекции тяжелой анемии у пациентов с коронарной болезнью сердца, но результаты ее эффективности противоречивы. Большинство данных получено при использовании либеральных или рестриктивных протоколов гемотрансфузий. Либеральный подход к переливанию крови был определен как гемотрансфузия при уровне гемоглобина менее 90 г/л. Рестриктивная трансфунзионная стратегия — трансфузия с уровнем гемоглобина менее 70 г/л. Метаанализ 10 исследований, включавший 203,665 пациентов с острым коронарным синдромом выявил, что либеральная гемотрансфузия ассоциировалась с увеличением общей смертности по сравнению с рестриктивной гемотрансфузией или ведением пациентов без нее [32]. Но стоит отметить, что гемотрансфузия ассоциировалась со значимым увеличением риска смерти к 30-му дню только при показателе гематокрита более 25% [32].
На сегодняшний день нет единого мнения в отношении либеральной и рестриктивной гемотрансфузионной тактики у пациентов с ИБС. Ряд исследований с низкой степенью доказательности показывают, что ограничительная трансфузия не оказывает эффект на смертность у пациентов с коронарной патологией сердца по сравнению с либеральной трансфузией. Ряд исследований, основанных на клиническом наблюдении пациентов, выдвинули утверждение: гемотрансфузия не имеет практической пользы и может нанести вред пациентам с сердечно-сосудистой патологией при уровне гемоглобина более 100г/л [31]. Пилотное исследование, включавшее 110 пациентов с острым коронарным синдромом или стабильной стенокардией, которые подвергались коронарным вмешательствам, продемонстрировало, что гемоглобин менее 100г/л коррелировал с тенденцией к увеличению больших коронарных событий, включая смерть от сердечно-сосудистых причин у пациентов с либеральной по сравнению с рестриктивной стратегией гемотрансфузий [33].
Из-за противоречивых результатов исследований и недостатка полноценных рандомизированных контролируемых исследований рестриктивная гемотрансфузия может иметь место в условиях острого коронарного синдрома и у госпитализированных пациентов с коронарной болезнью сердца [31, 34].
Положительные эффекты лечения внутривенными препаратами железа при дефиците железа с анемией или без у пациентов с сердечной недостаточностью
Железо является жизненно необходимым элементом для организации целого ряда жизненно важных функций в организме. Оно служит переносчиком кислорода к клеткам, является частью важных ферментных систем в различных тканях. Железосодержащие ферменты выполняют функцию по переносу электронов внутри клетки, а их функция в окислительном метаболизме – перенос энергии внутри митохондрии. Другой ключевой функцией железосодержащих ферментов (например, цитохром Р450) является синтез стероидных гормонов и желчных кислот; обезвреживание токсинов в печени; контроль эффекта нейротрансмиттеров, таких как допамин, и серотониновых систем головного мозга [35].
Несколько исследований были адресованы лечению пациентов с заболеваниями сердца внутривенными препаратами железа. Данные Fair-HF исследования, которое включало пациентов с анемией и без продемонстрировали: только 27,6% пациентов, получавших препарат карбоксимальтозы железа внутривенно, имели кардиоваскулярные события по сравнению с 50,2% пациентов, получавших плацебо (р=0.01). Внутривенное назначение карбоксимальтозы железа увеличивало переносимость и продолжительность физических нагрузок у пациентов со стабильной сердечной недостаточностью и хроническим заболеванием почек (ХБП), не выше 3 стадии ХБП. У большинства пациентов, включенных в исследование, уровень ферритина был менее 100 мг/л [36]. Это исследование показало, что назначение 200 мг препарата карбоксимальтозы железа внутривенно увеличивало дистанцию теста 6-минутной ходьбы (317 м против 277 м) по сравнению с внутривенным назначением физиологического раствора [36]. Данное исследование с умеренной степенью доказанности продемонстрировало, что внутривенный препарат железа улучшал качество жизни у пациентов с анемией или дефицитом железа со стабильным течением ХСН и хроническим заболеванием почек не выше 3 стадии. Fair-HF исследование показало, что лечение внутривенным препаратом железа улучшало функциональный класс сердечной недостаточности и показатели качества жизни независимо от того, присутствовали в пациента лабораторные признаки анемии или нет [36]. Это исследование также продемонстрировало отсутствие статистически значимой разницы в частоте существенных побочных эффектов между пациентами, принимавшими внутривенно карбосимальтозу железа, и контрольной группой [36].
Целью CONFIRM-HF исследования было изучение долгосрочного эффекта от лечения препаратом карбоксимальтозой железа у пациентов с симптоматической сердечной недостаточностью и дефицитом железа. В исследование было включено 304 пациента со стабильной сердечной недостаточностью класса II или III согласно Нью-Йоркской Ассоциации Сердца (NYHA), с фракцией выброса левого желудочка ≤45%, повышенным уровнем натрийуритических пептидов (мозговой натрийуретический пептид >100 пг/мл и/или N-терминальный фрагмент натрийуритического пептида > 400 пг/мл), наличием дефицита железа (уровень сыворочного феритина < 100нг/мл, или от 100 до 300 нг/мл, если сатурация трансферрина < 20%) и гемоглобином до 15 г/дл.
В результате исследования было выявлено, что лечение стабильных симптоматических пациентов с сердечной недостаточностью и дефицитом железа внутривенным препаратом карбоксимальтозой железа приводит к устойчивому улучшению их функционального состояния согласно тесту 6-минутной ходьбы; улучшению качества жизни; значительному уменьшению риска госпитализаций вследствие прогрессирования сердечной недостаточности. Наблюдения за пациентами осуществлялось в течение одного года. Вышеперечисленные положительные эффекты были отмечены во всех подгруппах, включая пациентов с анемией или без нее [37].
Результаты CONFIRM-HF исследования по сравнению с Fair-HF имели более объективные первичную и конечную точки, показали более продолжительный положительный эффект от лечения карбоксимальтозой железа с хорошим профилем безопасности и продемонстрировали значительное снижение риска госпитализации вследствие ухудшения сердечной недостаточности [37].
Метаанализ всех рандомезированных контролируемых исследований, изучавших эффект лечения внутривенными препаратами железа у пациентов с систолической сердечной недостаточностью и дефицитом железа, показал, что ее применение у данной категории пациентов уменьшает риск комбинированных конечных точек: общей смертности и сердечно-сосудистых госпитализаций, сердечно-сосудистой смертности и госпитализации по поводу ухудшения сердечной недостаточности, и риск госпитализаций по причине декомпенсации ХСН. Не было выявлено значимого эффекта на общую и на смертность от сердечно-сосудистых причин. Вместе с тем, внутривенная терапия препаратами железа приводила к улучшению переносимости физических нагрузок, уменьшению симптомов сердечной недостаточности и улучшению качества жизни пациентов [38].
Внутривенное назначение препарата карбоксимальтозы железа должно рассматриваться в качестве лечения у симптомных пациентов с систолической сердечной недостаточностью и дефицитом железа для уменьшения клинических проявлений, повышения толерантности к физическим нагрузкам и улучшения качества жизни [39].
Заключение
Лечение анемии у пациентов с заболеваниями сердца может существенно отличаться от лечения анемии в общей популяции. Однако понимание доказательной базы и использование клинического суждения крайне необходимы для лечения данной категории лиц. Анемия коррелирует с ухудшением прогнозов у пациентов с кардиоваскулярной патологией и становится новой терапевтической мишенью для данной категории пациентов. Вопрос, является ли анемия причиной или маркером неблагоприятных исходов и отражает лишь тяжесть сердечно — сосудистого заболевания, остается актуальным по сей день.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, способного повлиять на результаты исследования или их трактовку.
Introduction. Cardiovascular disease is a significant health problem around the world and accounts for the majority of deaths annually. Many of such patients have anemia due to acute blood loss (surgery or trauma) or chronic conditions such as renal failure or cancer.
According to the World Health Organization criteria anemia is defined in cases when hemoglobin is less than 120 g/l in females and less than 30 g/l in males. It is a major health problem that increases the mortality rate, affects physical status, and demands referral to health-care professionals. Globally, anemia affects 1.62 billion people, which corresponds to 24.8% of the total population. The highest prevalence is in preschool-age children (47.4%), and the lowest prevalence is in men (12.7%). Half of the cases are due to iron deficiency [1] which affects not only red blood cell production but also cellular functions related to muscle metabolism, mitochondrial function, neurotransmitters, DNA synthesis, and the immune system [2].
Prevalence of anemia increases with the advanced age making it a common associated comorbidity in patients with cardiovascular diseases. It has been established that anemia is an independent risk factor for cardiovascular diseases (CVD) outcomes [3].
Effects of anemia on the cardiovascular system. Understanding the physiologic response to anemia is important in order to take into account the implications of this state in regards to cardiac diseases. Three main factors are responsible for oxygen delivery to organs: blood flow and its distribution; the oxygen-carrying capacity of the blood, i.e. hemoglobin concentration; and oxygen extraction. Hypoxia in anemia is compensated through several non-hemodynamic (increased erythropoietin production to stimulate erythropoiesis, increased oxygen extraction) and hemodynamic mechanisms. The main hemodynamic factors are decreased afterload, increased preload, and positive inotropic and chronotropic effects. Enhanced nitric oxide activity, hypoxia-induced vasodilatation and lower blood viscosity are responsible for reduced vascular resistance and lead to the decreased afterload. Chronic anemia stimulates angiogenesis and recruitment of new microvessels. Enhanced venous return (preload) and left ventricular (LV) filling lead to the increased LV end-diastolic volume and cardiac output. Increased cardiac output is responsible for arterial remodeling of the central elastic arteries such as the aorta and common carotid artery through arterial enlargement and compensatory arterial intima-media thickening, leading to the elevated systolic pressure and high inertia due to higher blood mass in the dilated arterial system. Activation of sympathetic activity enhances LV contractility, and the heart rate. Short-lasting anemia is reversible but in chronic anemia hemodynamic changes lead to cardiac enlargement and development of eccentric LV hypertrophy (LVH). It also occurs in other forms of the volume overload. In case of heart diseases chronic anemia contributes to a high incidence of cardiovascular complications [4].
Anemia in arterial hypertension
Normocytic anemia is common in hypertensive patients but more prevalent in uncontrolled hypertension. Lower hemoglobin is associated with poor blood pressure control, indicating a higher cardiovascular risk in uncontrolled hypertension [5]. It was noted that hypertensive patients with anemia had higher nocturnal systolic and mean blood pressure and a lower dipping status compared to the patients with normal hemoglobin levels. There was a trend for increased diastolic blood pressure [6].
In patients with isolated systolic hypertension and left ventricular hypertrophy lower hemoglobin was associated with the increased cardiovascular death or stroke [7].
Electrocardiographic changes in anemia.
Electrocardiographic (ECG) repolarization abnormalities (ST segment depression, T wave inversion, prolonged QT) are highly prevalent in anemic patients at rest and during the tests with physical loading [8]. It has been shown that the hemoglobin level is strongly correlated with ECG changes [9].
A long ECG QT interval duration is a predictor of ventricular arrhythmia and sudden cardiac death. Hypoxia and impaired oxygen supply in anemic patients may affect repolarization of the myocardium. It has been found that anemia, macrocytosis and anisocytosis are associated with prolonged QT intervals in hypertensive patients and may contribute to the risk of sudden cardiac death [10]. Low iron stores in otherwise healthy children negatively correlated with QT and QTc intervals and may indicate some risk in developing arrhythmias [11].
Mehta et al. showed significant reproducible ST depression in anemic patients with iron deficiency during the tests with physical loading. These electrophysiological changes were corrected after iron therapy, even before the rise of hemoglobin occurred, which may be explained by the effect of iron on the tissue level [12].
Anemia in Ischemic Heard Disease
Myocardial ischemia is defined as oxygen delivery that is insufficient to meet oxygen requirements. The determinants of myocardial oxygen demand are wall tension, heart rate and contractility. The determinants of myocardial oxygen delivery are arterial oxygen content and coronary arterial blood flow. The increase of oxygen delivery in response to the enhancement of oxygen demand occurs through the changes in coronary vascular resistance, as the extraction ratio of myocardium at rest is nearly 90% [13]. Patients without coronary artery disease, therefore, have a tremendous ability to compensate the decrease in coronary arterial oxygen content through distal vasodilatation but in the presence of coronary stenosis this compensatory mechanism has a limited ability.
It was proved that anemic animals have the increased infarct size, decreased cardiac function and the survival rate in case of acute myocardial infarction (MI). Transfusion of fresh blood to anemic animals up to 100 g/L Hb reduced the infarct size and improved the cardiac function. However, blood transfusion up to 120 g/L Hb was associated with larger infarcts [14].
Sabatine et al. found out a U-shaped relationship with clinical events by the 30th day: in patients with ST-elevation MI; the mortality rate was higher in those with the hemoglobin levels below 140g/L or above 170g/L, while in patients with non-ST elevation acute coronary syndrome (ACS), death, infarction and ischemia increased in case when hemoglobin levels were below 110g/L or above 160/L [15].
Anemia is a risk factor for ischemic heart disease. Patients with ischemic heard disease (IHD) and anemia have a more advanced degree of ischemic heart disease compared to patients with isolated IHD. In anemic patients with IHD the level of hemoglobin, serum iron and total iron-binding capacity negatively correlated with the severity of IHD [16]. The mortality rate in anemic patients with IHD was higher than in patients with isolated IHD [16]. Anemia was an independent predictor of acute coronary syndrome based on the hemoglobin level, while both anemia and a high hematocrit level were predictors of myocardial infarction based on hematocrit [17].
The investigations made by Ferreira et al. revealed that hemoglobin<108g/L was one of the strongest independent predictors of one-year mortality in population with acute coronary syndrome (ACS). He suggested including the hemoglobin level in risk stratification scores of patients admitted for ACS, given that it is an easy parameter to measure and is systematically assessed at admission [18].
In the Cadilac trial anemia was common in patients with AMI who underwent primary PCI and was strongly associated with the adverse outcomes and increased mortality [19]. Anemia was an independent predictor of in-hospital mortality by the end of the first year [19].
Severe anemia can lead to disbalance between oxygen delivery and demand in the myocardium even in patients without coronary stenosis. Bailey D et al. reported a case of the ST segment elevation myocardial infarction (STEMI) secondary to severe anemia which occurred in the absence of angiographically significant coronary artery stenosis, thrombosis or coronary artery spasm [20].
Thus, there are a number of reasons for the worse outcomes in anemic patients with the obstructive coronary artery disease. Diminished oxygen-carrying capacity, activation of the sympathetic nervous system can increase myocardial oxygen demand and worsen ischemia.
Anemia in Heart Failure
Anemia is a very common comorbidity in chronic heart failure. Anemic patients are elderly women with more advanced symptoms and signs of heart failure, greater functional impairment and a higher hospitalization rate; they have a history of diabetes mellitus, renal insufficiency, and hypertension [21]. Anemia is a powerful predictor of rehospitalization rates and survival in case of chronic heart failure [22]. The prevalence of anemia increases with the severity of heart failure (HF) and can reach 79.1% in those with Class IV according to the classification of the New York Heart Association [23].
Etiology of anemia in HF may be multifactorial and a number of potential mechanisms may be responsible for such a condition in heart failure. Neurohormonal and inflammatory activation, renal dysfunction, bone marrow hyporesponsiveness, malnutrition, drug effects contribute to its development. Increased circulating proinflammatory cytokines enable defective iron mobilization, inappropriate erythropoietin production, depressed bone marrow function. Activation of the renin-angiotensin-aldosteron system, decreased renal perfusion caused by the low blood pressure and stroke volume stimulate the release of erythropoietin but the response is blunted due to effect of the circulatory cytokines. Poor nutrition due to anorexia, gastrointestinal malabsorbtion and aspirin use may precipitate iron deficiency anemia. Hemodilution can contribute to anemia. The use of the angiotensin-converting enzyme (ACE) inhibitor therapy may reduce secretion of erythropoietin [24].
Iron deficiency (ID) is the most frequent cause of anemia in patients with HF [25, 26] and can be revealed in ∼46% of non-anemic patients with stable systolic HF [27].
Iron deficiency may exist in absolute or functional forms. Absolute iron deficiency occurs when total body iron stores become exhausted and ID anemia can be considered as the final phase of iron stores depletion; functional iron deficiency refers to inadequate iron release in response to the demands of the bone marrow. Functional iron deficiency can be seen in many acute and chronic inflammatory states. ID is associated with the worsening of symptoms in patients with heart failure, impaired life quality, the increased mortality and hospitalization level [28, 29, 30].
Activation of sympathetic and renin-angiotensin-aldosteron systems, chronic inflammation, absolute and functional iron deficiency, impaired production and activity of erythropoietin, hemodilution, renal dysfunction impair prognosis in heart failure patients. Probably, anemia acts as a mediator and a marker of a poor prognosis in HF patients.
Treatment of anemia in patients with heart diseases. Anemia treatment strategies in heart failure and CHD patients include erythropoiesis-stimulating agents (ESAs), red blood cell transfusions and iron replacement in iron deficient patients with or without anemia.
Sixteen randomized, controlled trials assessed the impact of ESAs in patients with heart disease. Most of these studies included patients with CHF and the reduced systolic function. Overall, moderate-quality evidence showed no benefit from ESAs in regard to improving exercise tolerance and duration or quality of life, and high-quality evidence showed no mortality benefit [31]. Serious harmful effects associated with the treatment include mortality and vascular thrombosis [31]. So, the damage outweighs the benefits in treatment of patients with mild to moderate anemia using ESAs. Although anemia is common in patients with CHF and CHD, treatment with ESAs did not decrease mortality, cardiovascular events or hospitalization rates [31]. The American College of Physicians does not recommend using erythropoiesis-stimulating agents to patients with mild to moderate anemia and congestive heart failure or coronary heart disease [31].
Blood transfusion has been suggested to correct severe anemia in patients with coronary artery disease, but data in regard to its effectiveness are contradictory. In the majority of studies investigating different transfusion protocols, a liberal blood transfusion strategy was defined as any red blood cell transfusion at a hemoglobin level up to 90 g/L, while a restrictive blood transfusion strategy was defined as any transfusion at a hemoglobin level up to 70 g/L. A meta-analysis of 10 studies totaling 203 665 patients with acute coronary syndrome (both STEMI and NSTEMI-ACS) reported that blood transfusion or a liberal transfusion strategy was associated with the increased all-cause mortality, compared with no blood transfusion or a restrictive transfusion strategy [32]. However, a transfusion or liberal transfusion strategy was associated with a significantly higher mortality risk by the 30th day only in case when a nadir hematocrit is more than 25% [32].
However, low-quality evidence data demonstrate that blood transfusion using restrictive compared with liberal transfusion protocols had no effect on mortality in patients with CHD. Observational studies suggested that transfusion is not beneficial and may be harmful for patients with heart disease and hemoglobin levels of more than 100 g/L (31). A pilot trial of 110 patients with acute coronary syndrome or stable angina undergoing cardiac catheterization and hemoglobin <100 g/L revealed a trend of fewer major cardiac events and deaths in patients with the liberal transfusion strategy as compared with a more restrictive strategy [33].
Due to inconsistent results of the studies and the lack of adequately powered RCTs restrictive red blood cell transfusion strategy may be considered in the settings of ACS and for hospitalized patients with coronary heart disease [31, 34]
Benefits of using intravenous iron injections in treatment of iron deficiency with or without anemia in HF patients.
Iron has several vital functions in the body. It serves as a carrier of oxygen to the tissues, a transport medium for electrons within cells, and an integrated part of important enzyme systems in various tissues. Several iron-containing enzymes act as electron carriers within the cell and their role in the oxidative metabolism is to transfer energy within the cell and mitochondria. Other key functions for the iron-containing enzymes (e.g. cytochrome P450) include synthesis of steroid hormones and bile acids; detoxification of foreign substances in the liver; and signal controlling in some neurotransmitters, such as the dopamine and serotonin systems in the brain [5].
Few studies addressed to intravenous iron therapy for patients with heart disease. Data from Fair-HF study, which included patients with and without anemia demonstrated, that 27.6% of patients treated with intravenous iron carboxymaltose had cardiovascular events compared with 50.2% of patients receiving placebo (p=0.01). Moderate-quality evidence showed that intravenous iron administration increased exercise tolerance and duration in patients with stable CHF including patients with Stage 3 chronic kidney disease. FAIR-HF trial (Ferinject Assessment in Patients with Iron Deficiency and Chronic Heart Failure) included anemic and nonanemic patients, with the majority of them having ferritin levels less than 100 µg/L [36]. This trial showed that 200 mg of intravenous ferric carboxymaltose (FCM) increased a 6-minute walk distance (313 m vs. 277 m) compared with intravenous saline [36]. Moderate-quality evidence showed that intravenous iron improved quality of life in patients with anemia or iron deficiency, stable CHF, and chronic kidney disease excluding the patients with the 4th and 5th stages. The FAIR-HF study showed that intravenous iron treatment improved Patient Global Assessment scores compared with control patients and the improved NYHA functional class, regardless of the anemia status (hemoglobin level ≤120 g/L) [36]. This trial also showed improved life quality. [36]. There was no statistically significant difference in serious harmful effects between the intravenous iron treatment and the control groups [36].
The CONFIRM-HF trial was aimed at studying effects of long-term intravenous iron therapy in ferric carboxymaltose inpatients with symptomatic heart failure and iron deficiency. Totally 304 patients with stable ambulatory HF (class II or III according to New York Heart Association (NYHA) classification) and left ventricular ejection fraction (LVEF) ≤45%, elevated natriuretic peptides (brain natriuretic peptide >100 pg/mL and/or N-terminal-pro-brain natriuretic peptide>400 pg/mL), presence of ID (defined as serum ferritin level <100 ng/mL, or between 100 and 300 ng/mL if transferrin saturation was <20%) and hemoglobin (Hb) up to15 g/L were enrolled in the study. This study showed that treatment of stable, symptomatic, ‘iron-deficient HF patients with intravenous iron (FCM) results in sustainable improvement of functional capacity as measured over a 1-year period using the 6-MWT walking test, improvement in quality of life, significantly reduced risk of hospital admission due to worsening of HF during a1-year follow-up period. These favorable results were consistent across all pre-specified subgroups including patients with and without anemia [37].
The results of CONFIRM-HF compared with FAIR-HF had a more objective primary end-point, documented longer-term sustainability of beneficial effects of treatment with FCM and the acceptable safety profile (i.e. 12 months compared with 6 months or less in previous studies) and provided data on significant risk reduction of the hospitalization due to HF worsening [37].
A meta-analysis of all randomized controlled trials that investigated the effects of intravenous iron therapy in iron-deficient patients with systolic HF (also analyzed separately in anemic and non-anemic subjects) showed that intravenous iron therapy in patients with systolic HF and ID reduced the risk of the combined endpoint of all-cause death or cardiovascular hospitalization, the risk of the combined endpoint of cardiovascular death or hospitalization due to advanced HF. However there was no effect on either all-cause or cardiovascular mortality, parenteral iron therapy resulted in the improved exercise capacity (as reflected by a longer 6MWT distance) and life quality, and also in alleviation of HF symptoms (reduction in the NYHA class) [38].
Intravenous FCM should be considered in symptomatic patients with systolic heart failure and iron deficiency (serum ferritin level <100 ng/mL, or between 100 and 300 ng/mL if transferrin saturation <20%) in order to alleviate HF symptoms, and improve exercise capacity and life quality [39].
Conclusion. Management of patients with heart disease and anemia might appropriately differ from that of the general population. Hence, clinical judgment and understanding the evidence base are critical when managing these patients. Anemia is associated with worse outcomes in patients with cardiovascular diseases. However, it is uncertain if anemia is the cause or the marker of poor outcomes and thus it only reflects advanced cardiovascular disease.
1. de Benoist B. et al., eds. Worldwide prevalence of anaemia 1993-2005. WHO Global Database on Anaemia Geneva, World Health Organization, 2008.
2. von DrygalskiA., Adamson J. W. Ironing out fatigue. Blood,2011, vol. 118, pp. 3191-3192.
3. Sarnak M. J., Tighiouart H., Manjunath G., MacLeod B., Griffith J., Salem D., Levey A. S. Anemia as a Risk Factor for Cardiovascular Disease in the Atherosclerosis Risk in Communities (ARIC) Study. J Am Coll Cardiology, 2002, vol. 40, no. 1, pp. 27-33.
4. Metivier F., Marchais S. J., Guerin A. P., Pannier B., London G. M. Pathophysiology of anaemia: focus on the heart and blood vessels, Nephrol Dial Transplant, 2000, vol. 15, no. 3, pp. 14-18.
5. Paul B., Wilfred N. C., Woodman R., Depasquale C. Prevalence and correlates of anaemia in essential hypertension. Clin Exp Pharmacol Physio, 2008, vol. 35, no. 12, pp. 1461-1464
6. Marketou M., Patrianakos A., Parthenakis F. Systemic blood pressure profile in hypertensive patients with low hemoglobin concentrations. Int J Cardiol, 2010, vol. 142, no. 1, pp. 95-96.
7. Marianne L. Smebye Emil K. Iversen A. H. Effect of Hemoglobin Levels on Cardiovascular Outcomes in Patients With Isolated Systolic Hypertension and Left Ventricular Hypertrophy (from the LIFE Study). Am J Cardiol, 2007, Sep 1, vol. 100, no. 5, pp. 747-912.
8. Stanojevic M., Stankov S. Electrocardiographic changes in patients with chronic anemia. Srp Arh Celok Lek, 1998, Nov-Dec. 126, no. 11-12, pp. 461-466.
9. Gv S., Pk S., Herur A., Chinagudi S., Patil S. S., Ankad R. B., Badami S. V. Correlation Between Haemoglobin Level and Electrocardiographic (ECG) Findings in Anaemia: A Cross-Sectional Study. J Clin Diagn Res, 2014, vol. 8, no.:4, doi: 10.7860/ JCDR/2014/8966.4202.
10. Mozos I., Serban C., Mihaescu R. Anemia and the QT interval in hypertensive patients. Int J Coiiabor Res Int Med Public Health, 2012, vol. 4, no 12, pp. 2084-2091.
11. Karadeniz C., Ozdemir R., Demirol M., Katipoglu N., Yozgat Y., Mege T., Onal N. Low Iron Stores in Otherwise Healthy Children Affect Electrocardiographic Markers of Important Cardiac events. Pediatr Cardiol, 2017, vol. 38, no. 5, pp. 909-914.
12. Mehta B. C., Panjwani D. D., Jhala D. A. Electrophysiologic abnormalities of heart in iron deficiency anemia. Effect of iron therapy. Acta Haematol, 1983, vol. 70, no. 3, pp. 189-193.
13. Hoffman J. I. Determinants and prediction of transmural myocardial perfusion. Circulation, 1978, vol. 58, pp. 381-339.
14. Hu H., Xenocostas A., Chin-Yee I., Lu X., Feng Q., Effects of anemia and blood transfusion in acute myocardial infarction in rats. Transfusion, 2010, vol. 50, no. 1. pp. 243-251.
15. Sabatine M. S., Morrow D. A., Giugliano R. P., Burton P. B., Murphy S. A., McCabe C.H., Gibson C. M., Braunwald E. Association of hemoglobin levels with clinical outcomes in acute coronary syndromes. Circulation, 2005, vol. 111, pp. 2042-2049.
16. Zeidman A., Fradin Z., Blecher A., Oster H. S., Avrahami Y., Mittelman M., Anemia as a risk factor for ischemic heart disease. Circulation. 2004, vol. 6, no. 1, pp. 16-18.
17. Mahmoodi M. R., Kimiagar S. M., Abadi A. R. Is anemia an independent predictor of occurrence of acute coronary syndrome? Results from the modares heart study. Am Heart Hosp J, 2007, vol. 5, no. 2, pp. 73-79.
18. Ferreira M., Antonio N., Gongalves F., Hemoglobina: um mero valor analitico ou um poderoso preditor de risco em doentes com sindromes coronarias agudas? Revista Portuguesa de Cardiologia, 2012, vol. 31, pp. 121-130.
19. Nikolsky E., Aymong E. D., Halkin A., Grines C. L., Cox D. A., Garcia E., Mehran R., Tcheng J. E., Griffin J. J., Guagliumi G., Stuckey T., Turco M., Cohen D. A., Negoita M., Lansky A. J., Stone G. W. Impact of anemia in patients with acute myocardial infarction undergoing primary percutaneous coronary intervention: Analysis from the controlled abciximab and device investigation to lower late angioplasty complications (cadillac) trial. J Am Coll Cardiol, 2004, Aug 4, vol. 44, no. 3, pp. 547-553.
20. Bailey D., Aude Y. W., Gordon P., Burtt D. ST-segment elevation myocardial infarction, severe anemia and nonobstructive coronary disease: case report and brief comment. Conn Med, 2003, vol. 67, no. 1, pp. 3-5.
21. Ezekowitz J. A., McAlister F.A., Armstrong P. W. Anemia is common in heart failure and is associated with poor outcomes: Insights from a cohort of 12,065 patients with new- onset heart failure. Circulation, 2003, vol. 107, pp. 223-225.
22. Mozaffarian D., Nye R., Levy W. C. Amemia predicts mortality in severe heart failure: The Prospective Randomized Amlodipine Survival Evaluation (PRAISE). J Am Coll Cardiol, 2003, vol. 41, pp. 1933-1939.
23. Silverberg D. S., Wexler D., Blum M., Keren G., Sheps D., Leibovitch E., Brosh D., Laniado S., Schwartz D., Yachnin T., Shapira I., Gavish D., Baruch R., Koifman B., Kaplan C., Steinbruch S., Iaina A. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia of severe, resistant congestive heart failure improves cardiac and renal function and functional cardiac class, and markedly reduces hospitalizations. J Am Coll Cardiol, 2000, vol. 35, no. 7, pp. 1737-1744.
24. Tang Y. D., Katz S. D. Anemia in chronic heart failure: Prevalence, etiology, clinical correlates and treatment options. Circulation, 2006, vol. 113, pp. 2454-2461.
25. Nanas J. N., Matsouka C., Karageorgopoulos D., Leonti A., Tsolakis E., Drakos S. G., Tsagalou E. P., Maroulidis G. D., Alexopoulos G. P., Kanakakis J. E., Anastasiou-Nana M. I. Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol, 2006, vol. 48, pp. 2485-2489.
26. Jankowska E. A., von Haehling S., Anker S. D., Macdougall I. C., Ponikowski P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J, 2013, vol. 34, pp. 816-829.
27. Klip I. T., Comin-Colet J., Voors A. A., Ponikowski P., Enjuanes C., Banasiak W., Lok D. J., Rosentryt P., Torrens A., Polonski L., van Veldhuisen D. J., van der Meer P., Jankowska E. A. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J, 2013, vol. 165, pp. 575-582.e3.
28. Jankowska E. A., Rozentryt P., Witkowska A., Nowak J., Hartmann O., Ponikowska B., Borodulin-Nadzieja L., Banasiak W., Polonski L., Filippatos G., McMurray J.J., Anker S. D., Ponikowski P. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J, 2010, vol. 31, pp. 1872-1880.
29. Jankowska E. A., Rozentryt P., Witkowska A., Nowak J., Hartmann O., Ponikowska B., Borodulin-Nadzieja L., von Haehling S., Doehner W., Banasiak W., Polonski L., Filippatos G., Anker S. D., Ponikowski P. Iron deficiency predicts impaired exercise capacity in patients with systolic chronic heart failure. J Card Fail, 2011, vol. 17, pp. 899-906.
30. Enjuanes C., Klip I. T., Bruguera J., Cladellas M., Ponikowski P., Banasiak W., van Veldhuisen D. J., van der Meer P., Jankowska E. A., Comin-Colet J. Iron deficiency and health-related quality of life in chronic heart failure: results from a multicenter European study. Int J Cardiol, 2014, vol. 174, pp. 268-275. doi: 10.1016/j.ijcard.2014.03.169.
31. Qaseem A., Humphrey L. L., Fitterman N., Starkey M., Shekelle P. Clinical Guidelines Committee of the American College of Physicians.Treatment of Anemia in Patients With Heart Disease: A Clinical Practice Guideline From the American College of Physicians. Ann Intern Med, 2013, vol. 159, no. 11, pp. 770-779.
32. Chatterjee S., Wetterslev J., Sharma A., Lichstein E., Mukherjee D. Association of blood transfusion with increased mortality in myocardial infarction: a meta-analysis and diversity-adjusted study sequential analysis. JAMA Intern Med, 2013, vol. 173, pp. 132-139.
33. Carson J. L., Brooks M. M., Abbott J. D., Chaitman B., Kelsey S. F., Triulzi D. J., Srinivas V., Menegus M. A., Marroquin O. C., Rao S. V., Noveck H., Passano E., Hardison R. M., Smitherman T., Vagaonescu T., Wimmer N. J., Williams D. O. Liberal versus restrictive transfusion thresholds for patients with symptomatic coronary artery disease. Am Heart, 2013, vol. 165, no. 6, pp. 964-971.
34. Roffi M., Patron C. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J, 2016, vol. 37, pp. 267-315. doi:10.1093/eurheartj/ehv320.
35. Gupta C. P. Role of Iron (Fe) in Body. J Appl Chem (IOSR-JAC), 2014, vol. 7, no. 11, pp. 38-46.
36. Anker S. D., Comin C. J., Filippatos G., Willenheimer R., Dickstein K., Drexler H., Luscher T. F., Bart B., Banasiak W., Niegowska J., Kirwan B. A., Mori C., von Eisenhart R. B., Pocock S. J., Poole-Wilson P.A., Ponikowski P. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, vol. 361, no. 25, pp. 2436-2448.
37. Ponikowski P., van Veldhuisen D. J., Comin-Colet J., Ertl G., Komajda M., Mareev V., McDonagh T., Parkhomenko A., Tavazzi L., Levesque V., Mori C., Roubert B., Filippatos G., Ruschitzka F., Anker S. D. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J, 2015, vol. 36, no. 11, pp. 657-658.
38. Jankowska E. A., Tkaczyszyn M., Suchocki T., Drozd M., von Haehling S., Doehner W., Banasiak W., Filippatos G., Anker S. D., Ponikowski P. Effects of intravenous iron therapy in iron-deficient patients with systolic heart failure: a meta-analysis of randomized controlled trials. Eur J Hearts Faii, 2016, vol. 18, no. 7, pp. 786-795. doi:10.1002/ejhf.473
39. Ponikowski P., Voors A. A., Anker S. D., Bueno H., Cleland J. G., Coats A. J., Falk V., Gonzalez-Juanatey J.R., Harjola V. P., Jankowska E. A., Jessup M., Linde C., Nihoyannopoulos P., Parissis J. T., Pieske B., Riley J. P., Rosano G. M., Ruilope L. M., Ruschitzka F., Rutten F. H., van der Meer P. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. RevEsp Cardiol (Engl Ed). 2016, vol. 69, no. 12, p. 1167. doi: 10.1016/j.rec.2016.11.005.
Острый лимфобластный лейкоз (ОЛЛ) у детей и подростков
Три фазы лечения
Лечение ОЛЛ включает в себя 3 фазы и длится от 2 до 3 лет. Основным методом лечения ОЛЛ является химиотерапия. В химиотерапии используются мощные лекарственные препараты для остановки роста опухолевых клеток, уничтожая их или препятствуя их делению. Детям чаще всего назначают комбинацию различных лекарственных препаратов. Эти препараты могут вводиться в кровоток (внутривенно), приниматься внутрь (перорально) или же вводиться непосредственно в спинномозговую жидкость (интратекально).
Выбор метода химиотерапии и лекарственных средств зависит от группы риска ребенка. Дети с лейкозом высокого риска обычно получают больше противоопухолевых препаратов и/или более высокие дозы, чем дети с ОЛЛ низкого риска.
1. Индукция
Целью индукционной терапии является уничтожение бластных клеток в крови и костном мозге и перевод заболевания в ремиссию. Эта фаза обычно длится 4–6 недель. В это же время для уничтожения бластных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). В этом случае препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими спинной мозг (интратекально).
Для лечения используется комбинация химиотерапевтических препаратов. Эти препараты могут включать в себя винкристин, стероиды и пэгаспаргазу или аспарагиназу Erwinia, иногда с препаратом антрациклинового ряда, таким как доксорубицин или даунорубицин. В некоторых протоколах во время индукционной терапии применяют схему лечения, включающую циклофосфамид, цитарабин и 6-меркаптопурин.
2. Фаза консолидации/интенсификации
Целью терапии консолидации/интенсификации является уничтожение любых оставшихся клеток, способных к росту и вызывающих рецидив лейкоза. Эта фаза обычно длится 8-16 недель.
Пациенту назначают различные лекарственные средства, такие как циклофосфамид, цитарабин и или 6-меркаптопурин (6-МП). Также может назначаться метотрексат с терапией под защитой лейковорином или без нее.
3. Фаза стабилизации/продолжения
Целью поддерживающей терапии, последней и наиболее долгой фазы, является уничтожение любых опухолевых клеток, которые могли бы выжить после первых 2 фаз. Фаза стабилизации может продолжаться 2 или 3 года.
Эта фаза может включать в себя применение таких препаратов, как метотрексат, винкристин, стероиды, 6-меркаптопурин (6-МП). Пациентам с высоким риском могут назначаться антрациклиновые препараты, циклофосфамид и цитарабин.
Гемоглобин у ребенка на ГВ в возрасте около года — 15 ответов на Babyblog
Девочки, хочу понять, насколько сниженный гемоглобин является нормой для грудничков.
У нас 98 (9,5 месяцев). Но часто читаю про низкий гемоглобин…
Пожалуйста, напишите, какой гемоглобин был у вашего малыша в возрасте 9-15 месяцев (не раньше).
Опрос только для полного ГВ и прикорма.
Спасибо
Дополню свой пост.
Искала, что пишут об этом явлении на просторах интернета. Наткнулась на интересный пост. Пишет врач с форума Котока. Речь идет о постановке диагноза железодефицитная анемия слабой степени. Ребнку около года.
http://1796kotok.com/forum/viewtopic.php?f=12&t=28878&hilit=Низкий+гемоглобин+у+ребенка
Первый вопрос — почему сдавали анализы? Вас беспокоили какие-то проявления, и вы решили обследоваться? На предмет чего? Или вы просто пришли на плановый осмотр со здоровым ребенком и получили все эти цифры и анализы и теперь думаете, что с этим делать?
Я правильно понимаю, что у вас единственная цифра гемоглобина? Начнем с того, что даже уровень гемоглобина не меряется вот так однократно. Один замер не значит ничего совершенно, — он мог быть ошибочным, он мог произойти невовремя (скажем, ребенок выходил из легкой простуды или наоборот, заболевал), он ничего нам не говорит о динамике даже одного-единственного показателя минерала в крови — он падает? Поднимается? Стоит там уже сколько-то месяцев?
Далее, низкий гемоглобин (предположим, мы уже выполнили три анализа с должным интервалом и видим динамику, и он действительно ниже среднестатистического) и ЖДА — далеко не одно и то же. (Впрочем, и ЖДА-то не болезнь сама по себе, а скорее сопровождение других состояний, которые и определяют всю картину). У ребенка старше 6 месяцев, который еще не ест мяса, и не приходится ждать высокого или даже среднего гемоглобина — он будет низким, потому что он и должен быть низким, он подходит к концу своих врожденных запасов и материнское молоко индивидуально может обеспечивать потребности по самому минимуму, без излишеств. И это если не было ничего такого, что бы дополнительно снижало гемоглобин, — болячки там всякие временные. То есть, отвечая на ваш изначальный вопрос — не пищевой интерес следствие низкого гемоглобина, а низкий гемоглобин вполне закономерен при еще не развившемся пищевом интересе.
Ну и наконец, подходим к главному апрельскому тезису — добавки железа в таком возрасте, как правильно и опасается назначающий — не «поднимут» вам гемоглобин. Вообще практика лечения анализов чревата последствиями для здоровья вплоть до инвалидности (если взяться всерьез действительно), а уж препараты железа на формирующуюся проницаемую еще слизистую ЖКТ, будете смеяться — но таки могут еще этот гемоглобин понизить. Да фиг бы с ним с гемоглобином — он абстрактная цифра, — но печень, кишечник и селезенка у ребенка вполне реальные, и должны служить всю длинную жизнь, других не будет. И ромашковый чай, как вы и сами уже понимаете — не фактор защиты.
Возвращаясь к позитиву — что теперь делать, — зависит от того, что вы хотите делать, как обычно. Анализы лечить смысла нет, они не живые организмы, они цифры :). Если вы полагаете, что ребенок нездоров (а из перечисленного вами разве что бледность, вялость и капризность могут наводить на подозрения, да и то, если все это для ребенка нехарактерно), то есть смысл разобраться, что происходит. Может оказаться, что у вас банально режутся зубы, допустим. Или вы подхватили свой первый вирус. Прививки делали? 😈 Тоже гигантское поле для последствий, если делали. Ну и наконец, как наименее вероятный сценарий, могут быть всякие нелады с метаболизмом, но о них пойдет речь, когда все остальное отпадет и уж точно не на основании одного низкого гемоглобина
И таки да — в вашем молоке содержится железо в такой форме, которая усваивается ребенком с максимальной биодоступностью, какая только существует в природе. Его там может быть не много, но то, что есть, усваивается как ничто другое (даже если его съесть много, оно пройдет насквозь, травмируя систему и ничем не помогая). То есть, чем больше молока, тем больше железа. Из этих соображений — если вы таки даете ребенку воду, то ее стоит убрать. Она не нужна, если не съедается значительных количеств твердой пищи, а молоко содержит достаточно жидкости, чтобы обеспечить потребности в воде.
И, в заключении, нормы гемоглобина у детей.
По данным ВОЗ, у 30% детей на грудном вскармливании в возрасте 1 года гемоглобин ниже, чем у их сверстников, не получающих грудное молоко. Такое количество «отклонений от нормы» может свидетельствовать не о распространенности патологии, а о том, что для детей на ГВ более низкие показатели гемоглобина в возрасте 1 года являются физиологической нормой.
Возраст ребенка Норма гемоглобина г/л
1—3 дня 145-225
1 неделя 135-215
2 недели 125-205
1 месяц100-180
2 месяца 90—140
3-6 месяцев 95-135
6 мес. – 1 год 100 – 140
1 — 2 года 105 -145
3 — 6 лет 110 -150
7-12 лет 115 -150
13 – 15 лет 115- 155
16 -18 лет 120 – 160
ТОП-5 способов, как повысить гемоглобин ребенку
Каким должен быть гемоглобин у ребенка, причины низких показателей и пять способов, как поднять гемоглобин у детей.
пятница, сентября 28th, 2018
Присоединяйтесь к Клубу Заботливых Мам NestleBaby®!
Зарегистрируйся сегодня
Получайте полезные советы и принимайте участие в тестировании продукции
Гемоглобин – главный строительный компонент эритроцитов (красных кровяных телец). Его главная задача: транспортировать кислород от легких в клетки организма и забирать углекислый газ. Неудовлетворительный уровень этого железосодержащего белка ведет к кислородному голоданию и, как следствие, к ухудшению здоровья малыша. Риски велики: от снижения иммунитета и появления кожных заболеваний до сердечной недостаточности и задержки развития. Какие же показатели считаются нормальными, а когда следует срочно посетить врача? И как повысить гемоглобин ребенку?
Допустимый уровень гемоглобина
Главное, что нужно знать: нормы железа в крови разные для разного возраста. Так, самый высокий показатель у младенцев – сразу после рождения и в течение последующих 2-4 недель уровень гемоглобина может составлять 125-240 г/л.
Многое также зависит от питания будущей матери: если рацион был разнообразным, крохе достанется хороший запас железа.
Спустя месяц после появления на свет гемоглобин у малыша падает и теперь колеблется в пределах 115-200 г/л. В полгода цифры снова меняются: 110-140 г/л. А здоровые детки, которым исполнился один год, имеют показатели 110-140 г/л.
Фруктово-злаковые батончики Gerber® — удобный формат перекуса для ребенка старше года: содержит от 46% фруктов в составе; без добавления сахара и крахмала.
УЗНАТЬ БОЛЬШЕ
Низкий уровень железа
Если показатели ниже 100-110 г/л, время обратиться к врачу. Наибольший риск несут цифры ниже 60 г/л.
Самый простой способ определить уровень железосодержащего белка – сдать общий анализ крови.
Почему гемоглобин у ребенка ниже нормы
Наиболее распространенные причины:
- Плохое питание
- Инфекционные заболевания
- Заболевание ЖКТ
- Дефицит витаминов
- Недостаток кислорода
- Нехватка физической активности
- Малыш родился недоношенным
- Неправильное питание мамы во время беременности
- Генетическая предрасположенность
- Серьезная кровопотеря (после перенесенной операции или травмы)
Читайте также: Как питание женщины влияет на развитие плода?
Факторы снижения количества железосодержащего белка могут быть самые разные: от образа жизни, который ведет семья и сам малыш в частности, до перемены времени года и места проживания.
Симптомы низкого гемоглобина
Родителей должны насторожить такие симптомы у ребенка:
- Вялость, сонливость, постоянная усталость
- Плохой аппетит, апатия, депрессия
- Головокружение, головная боль, обмороки
- Нарушение дыхания, учащенное сердцебиение
- Бледность и сухость кожи, истончение волос
- Ухудшение памяти и концентрации внимания
- Отставание в физическом развитии (вес, рост)
Как повысить гемоглобин ребенку
Главный способ поддержания оптимального уровня белка – насыщение организма достаточным количеством железа и веществами, способствующими его наилучшему усвоению.
ТОП-5 способов поднять гемоглобин у детей
- Кормить младенца грудным молоком не менее 6 месяцев.
Материнское молоко – главный источник железа и особого белка – лактоферрина, улучшающего всасывание этого железа. Поэтому педиатры рекомендуют кормить ребенка грудью от полугода до года.
Читайте также: Режим питания грудных детей
- Обеспечить малышу сбалансированное питание
Рацион крохи должен содержать продукты, богатые на железо и способствующие лучшей усвояемости этого микроэлемента. Это мясо и субпродукты, яйца (желтки), рыба, хлеб из муки грубого помола, творог, бобовые (фасоль, чечевица, горох), шпинат, овощи (свекла, огурцы, брокколи), ягоды (садовые и лесные), фрукты (груши, яблоки, абрикосы, цитрусовые), гречка, орехи.
Читайте также: Яйца: сколько, когда, какие?
- Для профилактики – гематоген
Батончик гематогена – еще один способ улучшить показатели. А еще он питательный и вкусный и понравится малышу. О количестве и продолжительности приема рекомендуется уточнить у лечащего врача.
Гематоген – профилактическое средство для стимуляции кроветворения. В составе – сухая обработанная кровь крупного рогатого скота и вкусовые добавки: сгущенное молоко, аскорбиновая кислота, мед. Показан при неполноценном питании, дефиците железа, а также после недавно перенесенной болезни.
- Добавить физической нагрузки и свежего воздуха
Активный образ жизни и массаж помогают поднять гемоглобин у детей. Дополнительно не забывайте о регулярных прогулках на свежем воздухе (не менее двух часов в сутки) и о проветривании помещения.
- Обратиться к врачу
Наилучший способ предотвращения проблемы и развития осложнений – регулярная сдача анализов и осмотр у врача.
Повышать гемоглобин у ребенка можно только после обращения к специалисту. Врач установит причину, разработает план лечения и расскажет о профилактических мерах.
Статьи по теме:
Чем опасен дефицит железа
Питаемся правильно и без ошибок
Полезные вещества для развития мозга малыша
Подробнее
Определение гемоглобина ретикулоцитов – современный подход к диагностике железодефицитных состояний у детей | Пшеничная
1. Детская гематология. Клинические рекомендации. Под ред. Румянцева А.Г., Масчана А.А., Жуковской Е.В. М.: «ГЭОТАР-Медиа»; 2015. 656 с.
2. Демихов В.Г. Диагностика и лечение анемии в XXI веке. Сборник материалов II Всероссийской конференции. Рязань, 17–18 октября 2013 г.
3. Диагностика и лечение железодефицитной анемии у детей и подростков. Пособие для врачей. Под ред. Румянцева А.Г., Захаровой И.Н. М.; 2015. 76 с.
4. Жукова Л.Ю., Харчев А.В., Соколова Н.Е., Егоров А.С., Тарасенко А.Н. Железодефицитные анемии у подростков. Педиатр 2011; 2 (1): 25–31.
5. Козина Н.В., Соколова Н.Г. Адаптационный потенциал призывников срочной службы с дефицитом массы тела. Педиатр 2016; 7 (1): 173–7.
6. Пшеничная К.И., Жиленкова Ю.И. Дифференцированная оценка показателей обмена железа при гипохромных анемиях у детей. Педиатр 2016; (1): 27–31.
7. Барановская И.Б., Лузакова И.А., Напсо Л.И., Проскуряков М.Т., Ригер Н.А. Гемоглобин ретикулоцитов – дополнительный маркер диагностики ранней стадии железодефицитных состояний. [Электронный ресурс]. URL: http://www.rusnauka.com/8._NPE_2007/Medicine/20914.doc.htm (Дата обращения 04.01.2018).
8. Барановская И.Б., Онищук С.А. Гемоглобин ретикулоцитов в дифференциальной диагностике анемий. Вестник ОГУ 2008; (81): 129–30.
9. Павлов А.Д., Морщакова Е.Ф., Румянцев А.Г. Эритропоэз, эритропоэтин, железо. М.: «ГЭОТАР-Медиа»; 2011. 304 с.
10. Гемоглобинопатии и талассемические синдромы. Под ред. Румянцева А.Г., Токарева Ю.Н., Сметаниной Н.С. М.: Практическая медицина; 2015. 448 с.
11. Руководство по гематологии для практических врачей. Под ред. Воробьева А.И. Том 3. М.; 2005.
12. Румянцев А.Г., Морщакова Е.Ф., Павлов А.Д. Эритропоэтин в диагностике, профилактике и лечении анемий. М.; 2003. 448 с.
13. Семикина Е.Л. Новые технологии в автоматизированном анализе клеток крови: диагностическая значимость и возможность применения в клинической практике. Научно-образовательный форум «Новые инновационные и наукоемкие лабораторные технологии и тест-системы как вектор прогресса в клинической практике». Ростовна-Дону, 7 сентября 2016 г. [Электронный ресурс]. URL: http://ramld.ru/userfiles/file/RostovDon%202016/RostovDonSemykina.pdf. (Дата обращения 27.07.2020).
14. Погорелов В.М., Козинец Г.И., Дягилева О.А., Проценко Д.Д.. Цветной атлас клеток системы крови. М.: Практическая медицина, 2016. С. 16–38.
Анемия и полицитемия у новорожденных
Физиологическая анемия младенцев. Глэдер Б. В: Behrman RE, Kliegman RM, Jenson HB, eds.
Учебник педиатрии Нельсона. 17-е изд. Филадельфия, Пенсильвания: WB Saunders Co; 2004: 1610–
1611 Анемия у детей. Ирвин Дж. Дж., Кирхнер Дж. Т..
Я семейный врач. 2001; 64
: 1379–
1386 OpenUrlPubMed Дифференциальная диагностика и лечение анемии у новорожденных. Bizzarro MJ, Colson E, Ehrenkranz RA.Pediatr Clin North Am. 2004; 51
: 1087–
1107 OpenUrlCrossRefPubMed Неонатальная полицитемия. Garcia-Prats JA.
Своевременно. Доступно на: www.uptodate.com
Масса эритроцитов (эритроцитов) у новорожденных сильно варьируется. Когда младенец переходит из внутриутробной во внематочную среду, происходит изменение как массы, так и состава эритроцитов. Диапазон нормы, хотя и четко определен, широк из-за множества изменчивых переменных, влияющих на физиологию послеродового периода.
Внутриутробно преобладает гемоглобин плода. По сравнению с гемоглобином взрослого, гемоглобин плода обладает повышенной способностью связывать кислород, что обеспечивает достаточную передачу кислорода плоду при отсутствии газообмена с внешней средой. Даже при повышенном сродстве гемоглобина плода к кислороду внутриутробная среда относительно гипоксична. В результате уровень гемоглобина у недоношенного плода или доношенного ребенка относительно высок. Нормальная концентрация гемоглобина для доношенного новорожденного — 19.3 ± 2,2 г / дл (193 ± 220 г / л) с гематокритом 61% ± 7,4% (0,61 ± 0,074), значения, которые продолжают расти, пока не достигнут максимума примерно через 2 часа после рождения.
В течение первой недели после родов значения гемоглобина и гематокрита начинают падать в ответ на более высокую концентрацию кислорода в окружающей среде ex utero. Предполагается, что это повышение концентрации кислорода в сочетании с повышением процента гемоглобина взрослого,…
Питание и уровень железа у детей в возрасте 1 года после пересмотра рекомендаций по питанию для младенцев
Предыдущее исследование показало низкий уровень железа у 12- Месячные исландские младенцы сильнее всего связаны с потреблением коровьего молока и ростом.Рекомендации по питанию младенцев были пересмотрены в 2003 году. В этом исследовании изучались питание и уровень железа в новой когорте младенцев. Предметы / методы . Случайно выбранные младенцы были проспективно исследованы на предмет диеты, антропометрии и статуса железа (= 110–141). Результатов . Частота начала грудного вскармливания составила 98%; 38% детей в возрасте 5 месяцев находились на исключительно грудном вскармливании, а 20% детей в возрасте 12 месяцев были на частичном грудном вскармливании. Смесь давали 21% 6-месячных и 64% 12-месячных детей, а коровье молоко — 2.5% и 54,4% детей в возрасте 6 и 12 месяцев соответственно. Истощение запасов железа (сывороточный ферритин <12 мкг / г / л) затронуло 5,8%, 1,4% также страдали дефицитом железа (MCV <74 мкл) и ни у кого не было анемии (Hb <105 г / л). Статус железа отрицательно связан с ростом и продолжительностью грудного вскармливания и положительно с потреблением мяса и смесей в возрасте 9–12 месяцев, но не с коровьим молоком. Заключение . Повышенный уровень железа можно объяснить переходом с коровьего молока на смесь в рационе исландских детей в возрасте 6–12 месяцев.Изменения в диете изменили ассоциации между продуктами питания и статусом железа.
1. Введение
Достаточный уровень железа в младенчестве важен из-за его влияния на здоровье и развитие [1]. Младенцы особенно восприимчивы к железодефицитной (ЖД) и железодефицитной анемии (ЖДА), поскольку потребность в экзогенном железе быстро увеличивается во второй половине первого года жизни из-за высоких темпов роста в младенчестве.
Уровень железа в младенчестве отрицательно связан с потреблением коровьего молока [2, 3] и положительно с потреблением мяса [2, 4–6].Проспективное исследование исландских младенцев в 1995–1997 годах также обнаружило эти ассоциации, при которых 20% 12-месячных исландцев имели ID (средний корпускулярный объем (MCV) <74 fl, сывороточный ферритин (SF) <12 μ г / л. ), 2,7% имели ЖДА (гемоглобин (Hb) <105 г / л, MCV <74 fl, SF <12 μ г / л) и 41% были обедненными железом (SF <12 μ г / л ) [7]. Уровень железа у исландских младенцев был значительно хуже по сравнению с аналогичными группами младенцев в девяностых годах в Дании [2], Швеции [4] и Норвегии [8].12-месячные дети с дефицитом железа находились на грудном вскармливании на 2,5 месяца короче, чем дети без дефицита железа, и множественный регрессионный анализ показал, что влияние на статус железа почти всегда объяснялось потреблением обычного коровьего молока в возрасте 9 и 12 месяцев [7] . Более высокая скорость роста в течение первого года имела независимую отрицательную связь со статусом железа через 1 год (y). Кроме того, было обнаружено, что низкий уровень железа отрицательно влияет на более поздний рост и статус железа [9], а также на показатели моторного развития у 6-летних в развитом благополучном обществе, таком как Исландия [10].
В 2003 г. в Исландии были опубликованы пересмотренные рекомендации по питанию детей грудного возраста, в которых смесь, обогащенная железом, была рекомендована в период отлучения от груди с шестимесячного возраста [11]. Смесь, исландское последующее молоко, была доступна в каждом продуктовом магазине в готовом виде в картонных коробках по разумной цене. Грудному вскармливанию уделялось больше внимания, чем раньше, благодаря принятию рекомендации Всемирной организации здравоохранения (ВОЗ) о исключительно грудном вскармливании до шести месяцев [12] вместо 4-6 месяцев, как рекомендовалось ранее, а также путем поощрения частичного грудного вскармливания, предпочтительно до 1 года или дольше, если это подходит маме и ребенку.По сравнению с обычным коровьим молоком, формула, обогащенная железом, имеет более высокую концентрацию железа (0,75 мг против 0,023 мг / 100 г) и более низкую концентрацию белка (1,8 г против 3,4 г / 100 г) и дополнена другими питательными веществами, такими как витамин C (9 мг / 100 г) [13] для выполнения требований Кодекса Алиментариус, Регламент № 735/1997 [14]. Содержание железа невелико и соответствует другим молочным смесям, поддерживающим нормальный рост и уровень железа у здоровых младенцев [15]. Пересмотренные рекомендации предоставляются всем родителям новорожденных медицинскими работниками в медицинских центрах.Обогащение считается наиболее эффективной стратегией борьбы с дефицитом питательных веществ, но меры по просвещению по вопросам питания также эффективны для улучшения статуса железа у детей [16], а также для скрининга дефицита железа у более уязвимых групп населения [17].
Целью этого исследования было изучение проспективной когорты 12-месячных детей, в которой сбор данных происходил после выполнения пересмотренных рекомендаций по питанию младенцев, для оценки статуса железа и его связи с диетой и ростом.Более того, мы стремимся оценить влияние пересмотренных рекомендаций на питание и потребление питательных веществ младенцами и статус железа.
2. Предметы и методы исследования
2.1. Набор выборки
Статистическое управление Исландии собрало случайную выборку из 250 исландских младенцев, родившихся в 2005 году, с января по декабрь. Критерии участия были те же, что и в предыдущем проспективном исследовании питания детей грудного возраста 1995–1997 гг. [7]. Критериями были исландские родители, одноплодные роды, срок беременности 37–41 неделя, масса тела при рождении в пределах 10–90 перцентилей, отсутствие врожденных дефектов или врожденных хронических заболеваний, а также наличие у матери раннего и регулярного дородового ухода.Подходящими участниками было 196. Было получено информированное письменное согласие родителей, и вся индивидуальная информация обрабатывалась со строжайшей конфиденциальностью. Исследование было одобрено Национальным биоэтическим комитетом Исландии (VSNb2005040019 / 037) и зарегистрировано Управлением по защите данных Исландии (S2449 / 2005).
2.2. Оценка рациона питания
Данные о питании для детей от 0 до 4 месяцев были собраны путем анализа диетического анамнеза, включая вопросы о грудном вскармливании, вскармливании детских смесей, других пищевых продуктах и добавках.Родители ежемесячно заполняли записи о питании. Записи о взвешенных пищевых продуктах вели в течение трех дней подряд (72 часа) в 9 и 12 месяцев. Все продукты взвешивались на точных электронных весах (PHILIPS HR 2385, Венгрия; точность ± 1 г). Младенцы, находящиеся на грудном вскармливании, взвешивались в одной и той же одежде до и после каждого сеанса грудного вскармливания (модель Tanita 1583, Япония или модель Sega 336 7021099, Германия; обе с точностью ± 10 г) для оценки количества потребляемого грудного молока, как описано ранее [18 ]. Программа расчета питательных веществ, ICEFOOD, использовалась для расчета записей взвешенных пищевых продуктов [19].В возрасте 5–8 и 10–11 месяцев потребление оценивалось по 24-часовому отзыву продуктов питания с использованием обычных бытовых мер, таких как чашки и ложки.
2.3. Биохимический анализ и антропометрические измерения
В возрасте 12 месяцев были взяты образцы крови для анализа статуса железа. Hb, MCV и SF анализировались на счетчике Coulter Counter STKS в Ландспитали — Национальной университетской больнице Исландии. Определение для IDA включает в себя все три показателя ниже пороговых значений: Hb <105 г / л, MCV <74 fl и SF <12 μ г / л, для ID два последних показателя находятся ниже пороговых значений и истощение запасов железа как имеющие SF <12 мкм г / л [2, 7, 20, 21].Антропометрия, то есть вес, длина и окружность головы при рождении в 1, 2, 3, 5, 6, 8, 10 и 12 месяцев, регистрировалась в родильных домах и медицинских центрах.
2.4. Статистический анализ
Статистический анализ выполняли с помощью программного обеспечения SPSS (версия 17; SPSS INC, Чикаго, Иллинойс). Описательная статистика использовалась для характеристик участников и потребления пищи и питательных веществ, представленных в виде среднего значения и стандартного отклонения (SD) для нормально распределенных переменных и медианы с межквартильным размахом (IQR) для искаженных переменных.Для сравнения между двумя группами использовался независимый -тест, критерий Манна-Уитни или хи-квадрат.
Для определения предикторов индексов статуса железа у младенцев (Hb, SF и MCV) были построены многомерные регрессионные модели. В модели для SF использовались переменные, которые различались у младенцев с обедненным железом и младенцев, не обедненных железом. Из-за асимметрии распределения SF была преобразована логарифмически. Модель для каждого индекса статуса железа также включала их коррелирующие переменные (коэффициент корреляции Пирсона), а для взаимосвязанных переменных те, которые имели самую слабую корреляцию с каждым индексом статуса железа, были исключены из модели.Вес при рождении был скорректирован в моделях. Размер выборки 200, ожидаемый отсев 30%, дает мощность 90% для обнаружения влияния увеличения веса на 100 г на SF. Чтобы выявить разницу в статусе железа между предыдущей (1995–1997) и нынешней (2005–2007) когортами, мощность составила> 90%. Уровень значимости в исследовании был.
3. Результаты
3.1. Исследовательская группа
Всего в исследовании участвовал 141 младенец (73 мальчика и 68 девочек), 72% из 196 подходящих участников.Характеристики испытуемых и их родителей представлены в Таблице 1. Исключенные из исследования не отличались от участников по основным показателям, то есть по размеру при рождении, 3698,8 (340,6) г по сравнению с 3781,3 (368,2) г () и продолжительности исключительно грудного вскармливания. , 3,2 (1,8) месяца против 3,54 (1,8) месяца (). Характеристики, статус железа и антропометрия не различались между детьми с полными () и неполными () данными о питании, то есть значения Hb 120,4 (7,7) г / л против 121,3 (9,8) г / л (), значения SF 36.6 (22,1) μ г / л по сравнению с 35,1 (19,7) μ г / л () или вес в 12 месяцев 10038,5 (1018,4) г по сравнению с 10229,8 (1125,5) г ().
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Существенно отличается от мальчиков. 𝑃≤0,05 (независимый 𝑡-тест). † Медиана и межквартильный размах (IQR). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Рацион и потребление питательных веществ
В настоящем исследовании 97,8% матерей начали грудное вскармливание, 38,1% 5-месячных и 7,2% 6-месячных детей находились на исключительно грудном вскармливании, а 20,0% все еще находились на частичном грудном вскармливании в возрасте 12 месяцев.Среднее потребление пищи было одинаковым среди мальчиков и девочек, за исключением потребления молока (Таблица 2). Большая часть мальчиков находилась на исключительно грудном вскармливании в возрасте 6 месяцев и частично в возрасте 12 месяцев. Более высокая доля девочек получала смеси в возрасте 9 и 12 месяцев, но потребление обычного коровьего молока не различается между полами (таблица 2). Среднее (стандартное отклонение) потребление смеси для детей в возрасте 9–12 месяцев составляло 156 (14,9) г / день и только 43 (9,2) г / день для обычного коровьего молока. Добавки витамина D были выше среди мальчиков, чем среди девочек в возрасте 6 месяцев, 60 лет.2% среди мальчиков против 48,1% среди девочек (). Потребление фруктов было более распространенным, чем потребление овощей среди детей в возрасте 5–8 месяцев, 85% и более детей в возрасте 6–8 месяцев употребляли каши, а потребление молочных продуктов (за исключением питьевого молока или смеси) было умеренным; 1,2% 5-месячных и 26,8% 8-месячных потребляли какие-либо молочные продукты. Среднее потребление энергии испытуемыми было близко к расчетным среднесуточным потребностям (кДж / кг массы тела). Однако потребление белка превышало рекомендации для этой возрастной группы (таблица 3).Потребление питательных веществ между мальчиками и девочками существенно не различалось, за исключением потребления витамина А в возрасте 12 месяцев, которое было выше для девочек.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Медиана и межквартильный размах (IQR). † Средние значения включают детей, не вскармливаемых грудью. ‡ Пищевая группа включает детские пюре и свежие фрукты и овощи. Процентная доля соответствует младенцам, получающим фрукты или овощи. § Молочные продукты — это молочные продукты и сыр, кроме питьевого молока. || Существенно отличается от мальчиков (критерий Wh Манна-Уитни; ≤0,05). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Медиана и межквартильный размах (IQR). † Значительно отличается от мальчиков (критерий Wh Манна-Уитни; ≤0,05). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3. Состояние железа и связь с диетой, ростом и социально-демографическими факторами
Детей с ЖДА не было. На ИД пострадали 1,4% () детей, и 5,8% () детей страдали от истощения запасов железа. Не было обнаружено значительных гендерных различий по MCV и Hb, но у девочек был значительно более высокий уровень SF, 39,2 (17,5) μ г / л, по сравнению с 33,5 (24,6) μ г / л у мальчиков ().
Младенцы с обедненным железом имели меньший вес при рождении — 3402 (255,8) г по сравнению с 3805 (361,7) г () и более высокую скорость роста, чем дети, не обедненные железом.При сравнении младенцев с дефицитом железа и без него, пропорциональная прибавка в весе составила 2,04 (0,25) против 1,66 (0,34) (), абсолютная прибавка в весе 4,8 (0,6) кг против 4,3 (0,8) кг () от 0 до 6 месяцев, и 6,9 (0,8) кг против 6,3 (1) кг () от 0 до 12 месяцев, а рост в длину от 0 до 12 месяцев составил 18,5 (0,82) см против 17,0 (1,9) см (). Младенцы с обедненным содержанием железа имели более длительную продолжительность грудного вскармливания, 9,4 (3,5) месяца по сравнению с 7,6 (3,3) месяца, хотя и незначительно, и потребляли меньше смеси, 10,5 (16.3) г / день против 133,0 (159,9) г / день в 9 месяцев () и 33,5 (47,2) г / день против 187,3 (199,9) г / день в 12 месяцев (). Однако потребление витаминов и минералов с пищей существенно не различается между детьми с обедненным и не обедненным железом.
Уровень SF отрицательно связан с переменными роста в младенчестве, но положительно с массой тела при рождении. При росте от 0 до 12 месяцев пропорциональная прибавка в весе (с учетом веса при рождении) и абсолютная прибавка в длину коррелировали наиболее отрицательно с уровнем SF.Для роста от 0 до 6 месяцев прибавка веса наиболее отрицательно коррелировала с SF, но рост от 6 до 12 месяцев не коррелировал достоверно с переменной. После корректировки веса при рождении множественный регрессионный анализ показал, что уровень log SF у мальчиков снизился на 0,0201 μ г / л на каждые 100 г прибавки в весе от 0 до 6 месяцев, на 0,0174 μ г / л на каждые 100 г прибавки в весе. от 0 до 12 месяцев и 0,0823 μ г / л на каждый см прироста длины от 0 до 12 месяцев (Таблица 4).У девочек потребление смеси, обогащенной железом, каши (положительный результат) и хлеба (отрицательный результат) зависело от уровня log SF после поправки на массу тела при рождении (таблица 4).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| С поправкой на вес при рождении. — Связь не найдена. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Уровень Hb имел более слабую связь с переменными роста (положительно), чем уровень SF. У мальчиков Hb наиболее положительно связан с потреблением железа и мяса с пищей и наиболее отрицательно с продолжительностью грудного вскармливания; формула имела более слабую, но значимую связь с Hb (положительная). У девочек фрукты и молочные продукты были наиболее тесно связаны с уровнем гемоглобина (таблица 4). Уровень гемоглобина был ниже у детей, находящихся на исключительно грудном вскармливании в течение 5 месяцев или дольше, чем у детей, находящихся на исключительно грудном вскармливании менее 5 месяцев (118.6 г / л против 121,6 г / л). Исключительное грудное вскармливание было исключено из регрессионной модели, поскольку продолжительность частичного грудного вскармливания была более сильным предиктором уровня гемоглобина, а две переменные сильно коррелировали.
MCV не ассоциировался ни с одной переменной роста. У мальчиков единственной переменной, независимо связанной с MCV, имеющей пограничное значение, была продолжительность грудного вскармливания (отрицательная). У девочек уровень MCV наиболее положительно связан с потреблением железа с пищей, а более слабая связь с потреблением витамина С с пищей.
Не было обнаружено никакой связи между индексами статуса железа и социально-демографическими переменными, то есть местом проживания, образованием родителей, возрастом, ИМТ или привычками к курению.
4. Обсуждение
Настоящее исследование описывает состояние питания и железа у хорошо питающихся младенцев с низкой распространенностью ЖД и ЖДА, высокой массой тела при рождении и частотой грудного вскармливания. Диета в младенчестве изменилась в сторону рекомендаций по питанию младенцев, пересмотренных в 2003 году, а уровень железа улучшился по сравнению с результатами более раннего проспективного исследования сопоставимой общенациональной когорты.Грудное вскармливание увеличилось, но основное изменение в рационе — это смесь, обогащенная железом, которая заменила обычное коровье молоко во второй половине первого года жизни. Изменившаяся диета, похоже, исключила коровье молоко как основную переменную, влияющую на уровень ферритина и железа в сыворотке. Смесь была разработана на основе домашнего коровьего молока, чтобы уменьшить изменения в популяции младенцев, поскольку исландское коровье молоко имеет некоторые характеристики, отличные от основных брендов [22]. Расчетное потребление питательных веществ показало, что среднее потребление железа, цинка и кальция было ниже РСНП.Однако статус железа был приемлемым, несмотря на низкое потребление железа. Частично это можно объяснить неполной информацией о питательных веществах в базе данных, например, об органических детских кашах, которые обычно потреблялись исследуемым населением. По оценкам, RDI удовлетворяет потребности 97,5% всего населения, а RDI в цинке и кальции экстраполируется из RDI для взрослых, что может привести к излишне завышенным рекомендациям для младенцев. Поэтому риск дефицита может быть небольшим.Однако необходимы дальнейшие исследования витаминного и минерального статуса детей раннего возраста.
По сравнению с предыдущим исследованием питания детей грудного возраста (1995–1997) уровень железа у 12-месячных исландских младенцев значительно улучшился (Рисунок 1). Распространенность ИН снизилась с 20% до 1,4%, истощение запасов железа с 41% до 5,8% и ЖДА с 2,7% до 0. Участники двух исследований представляли собой общенациональные случайные выборки здоровых доношенных детей, аналогичные по социально-демографическим факторам. , то есть жилье, количество братьев и сестер, возраст родителей и образование [7], и поэтому сопоставимы.Уровень железа в исследовании младенцев 1995–1997 гг. Был хуже, чем в соседних странах [7], но согласно последним данным из скандинавских стран, в Исландии, по-видимому, более низкая распространенность детей с ИН, чем в других странах Северной Европы. В шведском и норвежском исследованиях 18% и 10% 12-месячных младенцев, соответственно, имели дефицит железа (SF <12 μ г / л) [4, 8], по сравнению с 5,8% в 2005–2015 гг. Представлена когорта младенцев 2007 года. В настоящем исследовании пороговое значение для уровня гемоглобина составляло 105 г / л, а для MCV — 74 fl, поскольку оно также использовалось в предыдущем исландском исследовании младенцев и других северных исследованиях для этой возрастной группы [2, 7, 20, 21] .Однако пороговые значения для младенцев спорны, и Всемирная организация здравоохранения рекомендует использовать 110 г / л для Hb у детей в возрасте от 6 до 59 месяцев и 79 fl для MCV у детей в возрасте от 1 до 1,9 лет. . Изменение пороговых значений Hb и MCV в наших когортах в соответствии со стандартами ВОЗ не повлияло на результат или заключение исследования, разница между двумя когортами была еще больше.
В настоящем исследовании отрицательная связь между статусом железа и обычным коровьим молоком, наблюдаемая в исследовании младенцев 1995–1997 годов, исчезла, поскольку потребление уменьшилось и была заменена смесью, обогащенной железом (рис. 2).Формула, обогащенная железом, имела слабую положительную связь со статусом железа. Показатели грудного вскармливания увеличились со времени предыдущего исследования, как частичного, так и исключительно грудного вскармливания, но показатели исключительно грудного вскармливания среди 6-месячных детей все еще остаются низкими. Частично это можно объяснить тем фактом, что данные по исключительно грудному вскармливанию были собраны на основе зарегистрированного количества потребляемой пищи в месячные дни рождения. Таким образом, значение исключительно грудного вскармливания среди 5-месячных детей может быть более репрезентативным для показателей исключительно грудного вскармливания в течение первых 6 месяцев, поскольку младенцы получали дополнительную диету в возрасте от 5 до 6 месяцев.Это также было замечено в других европейских странах с высокими показателями инициирования [23]. Длительное грудное вскармливание дает множество преимуществ, и оно даже связано с меньшим ожирением в 15-летнем возрасте [24]. Поэтому следует уделять больше внимания увеличению показателей грудного вскармливания в соответствии с рекомендациями ВОЗ [12]. В настоящем исследовании частичная продолжительность грудного вскармливания была отрицательно связана как с уровнем гемоглобина, так и с MCV у мальчиков, а исключительное грудное вскармливание в течение 5 месяцев или дольше также было связано с более низким уровнем гемоглобина, хотя в пределах нормы, это может поддерживать предложение о пересмотре оптимального продолжительность исключительно грудного вскармливания [25].В предыдущем исландском исследовании более длительная продолжительность грудного вскармливания была положительно связана со статусом железа. Это можно объяснить изменением общего рациона. Основным заменителем грудного молока в предыдущем исследовании было обычное коровье молоко, но в настоящем исследовании это была смесь, обогащенная железом. Кроме того, было показано, что низкое содержание железа в грудном молоке и недостаточный дополнительный источник железа в рационе отрицательно влияют на статус железа [26, 27]. Однако предполагается, что концентрация железа в грудном молоке повышается в период отлучения от груди [28].Грудное молоко как таковое не кажется важным компонентом в этом контексте, а всего диета; Достаточное потребление железа из дополнительной диеты и заменитель грудного вскармливания, то есть молоко или смесь, являются наиболее важными факторами для хорошего статуса железа в младенчестве.
Потребление мяса было наиболее сильно независимо связано с Hb в множественном регрессионном анализе настоящего исследования. Эта связь согласуется с исследованием 1995–1997 гг., И потребление мяса в этих двух исследованиях не различалось.Мясо является важным источником железа и известным усилителем хорошего статуса железа [4–6], и, очевидно, влияет на статус железа, даже несмотря на то, что потребление мяса в этой возрастной группе очень низкое.
Еще одним фактором, отрицательно связанным со статусом железа, который согласовывался в обоих исследованиях, была скорость роста. В настоящем исследовании дети с дефицитом железа заметно быстрее прибавляли в весе и длине тела, чем дети, не обедненные железом. Это различие также было замечено в исследовании 1995–1997 годов между детьми с дефицитом железа и детьми без него [7].Кроме того, исследование, проведенное в США, показало, что 20% детей ясельного возраста с избыточной массой тела имели ID по сравнению с 7% детей ясельного возраста с нормальным весом [29]. Было высказано предположение, что более быстрый рост в течение первого года отрицательно влияет на статус железа [9] и на ИМТ [30] в возрасте 6 лет. Вероятно, это связано с более высокими требованиями к железу из-за более высокой скорости роста [31]. Потребность в железе относительно велика во время быстрого роста младенчества, особенно в возрасте от 6 месяцев до 2 лет, поскольку доношенные дети от матерей без дефицита железа рождаются с достаточными запасами железа, чтобы их хватило на первые 4–6 месяцев. жизни [18].Однако было показано, что хронический дефицит железа в течение длительного периода отрицательно влияет на рост в развивающихся странах и некоторых уязвимых группах в развитых странах [10, 32, 33]. Ограничениями настоящего исследования могут быть неполный набор данных для 31 из 141 участника и отсутствие информации о статусе железа при рождении. Однако уровень железа или другие показатели, такие как антропометрия и социальный статус, не различались между теми, у кого были полные и неполные наборы диетических данных. У здоровых доношенных детей с нормальной массой тела при рождении маловероятно, что содержание железа при рождении влияет на статус в возрасте 12 месяцев.Таким образом, эти возможные пределы вряд ли повлияют на результаты и выводы настоящего исследования.
У мальчиков склады железа были хуже; их уровни SF были значительно ниже, чем у девочек, и 9,9% мальчиков были ниже пороговых значений по сравнению с 1,5% девочек, что нельзя объяснить просто различиями в темпах роста. Факторы питания и рост в большей степени влияли на содержание железа у мальчиков, чем у девочек (Таблица 4). Гендерные различия в уровне SF также были замечены в других исследованиях, и Domellöf et al.пришли к выводу, что это, возможно, связано с различиями в метаболизме железа из-за гормональных различий между полами [34]. Кроме того, более высокая доля мальчиков находилась на грудном вскармливании, и у них было более низкое потребление обогащенной железом смеси в возрасте 12 месяцев по сравнению с девочками в настоящем исследовании, что также может частично объяснять гендерные различия в статусе железа.
5. Заключение
Уровень железа среди 12-месячных исландцев значительно улучшился по сравнению с предыдущим исследованием младенцев.Самым большим изменением в рационе детей грудного возраста между двумя исследованиями является замена обычного коровьего молока смесью, обогащенной железом. Исследование демонстрирует изменение связи между индексами статуса железа и пищей при изменении диеты. Более низкое потребление коровьего молока устранило прежнюю связь с ферритином. Связь с продолжительностью грудного вскармливания, хотя и слабая, изменилась с положительной в предыдущем когортном исследовании на отрицательную в настоящем исследовании. Эффект от грудного вскармливания может быть в основном получен из другой используемой пищи, то есть молока или смеси, но не от грудного вскармливания как такового.Полученные данные также показывают эффективность и важность поиска решений проблем общественного здравоохранения с помощью более эффективных рекомендаций по питанию.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было поддержано Исландским исследовательским фондом (050424031) и Исландским исследовательским фондом для аспирантов (080740008). Авторы выражают огромную благодарность участвующим детям и их родителям, а также двум магистрантам, Гудрун Л.Гудмундсдоттир и Рагнхейдур Гуджонсдоттир за их помощь в сборе и анализе данных. Они также хотели бы поблагодарить сотрудников лабораторий Landspitali-The National University Hospital в Рейкьявике, Исландия, за анализ крови.
Анемия, (Возраст> 7 месяцев И
Резюме врача
Целевая группа превентивных служб США (1996 г.) Рекомендация:
Скрининг железодефицитной анемии с использованием гемоглобина или гематокрита рекомендуется для:
- Беременные.
- Младенцы из группы высокого риска.
Недостаточно доказательств, чтобы рекомендовать за или против рутинного скрининга на железодефицитную анемию у других бессимптомных лиц, но рекомендации против скрининга могут быть сделаны по другим причинам. Рекомендуется побуждать родителей кормить грудью своих младенцев и включать продукты, обогащенные железом, в рацион младенцев и детей младшего возраста. В настоящее время недостаточно доказательств, чтобы рекомендовать или против рутинного использования добавок железа здоровым младенцам или беременным женщинам.
Рекомендации CDC:
Младенцы от новорожденного до 12 месяцев и дети от 1 до 5 лет Специалисты в области здравоохранения должны обследовать всех младенцев и детей раннего возраста на предмет риска анемии. Пациенты с высоким риском или с известными факторами риска должны пройти скрининг на железодефицитную анемию с помощью стандартного лабораторного теста.
Универсальный скрининг младенцев и детей из группы высокого риска:
В возрасте от 9 до 12 месяцев, через 6 месяцев (от 15 до 18 месяцев) и ежегодно от 2 до 5 лет проверять лиц с высоким риском железодефицитной анемии, в том числе:
- Младенцы и дети из малообеспеченных семей
- Младенцы и дети, имеющие право на участие в программе WIC
- Младенцы и дети-мигранты или недавно прибывшие беженцы
Выборочный скрининг младенцев и детей с известными факторами риска:
- В группах младенцев и детей раннего возраста, не относящихся к группе высокого риска, проверяйте только тех, у кого есть известные факторы риска железодефицитной анемии:
В возрасте до 6 месяцев проводится скрининг недоношенных младенцев и младенцев с низкой массой тела при рождении, которые получают детскую смесь, не обогащенную железом.
В возрасте от 9 до 12 месяцев и через 6 месяцев (в возрасте от 15 до 18 месяцев) просмотрите следующее:
- Младенцы, рожденные недоношенными или с низкой массой тела
- Младенцы, вскармливаемые не обогащенной железом детской смесью более 2 месяцев
- Младенцы, вскармливаемые коровьим молоком до 12 месяцев
- Младенцы на грудном вскармливании, не получающие достаточного количества железа из прикорма после 6 месяцев
- Дети, потребляющие более 24 унций коровьего, козьего или соевого молока в день после 12 месяцев
- Дети с особыми медицинскими потребностями, которые принимают лекарства, препятствующие всасыванию железа (например,g., антациды, кальций, фосфор, магний), а также при хронической инфекции и воспалении, ограничительных диетах или обширной кровопотере
В возрасте от 2 до 5 лет ежегодно проверять:
- Дети, которые придерживаются диеты с низким содержанием железа
- Дети с ограниченным доступом к пище из-за бедности или безнадзорности
- Дети с особыми потребностями в уходе
Дети в возрасте от 5 до 12 лет и юноши в возрасте от 12 до 18 лет
- Проверяйте только лиц с известными факторами риска, такими как низкое потребление железа, особые медицинские потребности или анемия железодефицитной анемии.
Девочки-подростки в возрасте от 12 до 18 лет и небеременные женщины детородного возраста
- Ежегодно проверяйте людей с известными факторами риска, такими как обширная менструальная или другая кровопотеря, низкое потребление железа или анемия железодефицитной анемии.
- Проверяйте каждые 5–10 лет во время плановых медицинских осмотров.
Беременные, подростки и женщины
- Скрининг на анемию при первом посещении дородовой помощи.
Мужчины 18 лет и старше
- Регулярный скрининг не рекомендуется.Дефицит железа или анемия, обнаруженные во время обычных обследований, должны быть полностью обследованы.
Это напоминание побуждает врачей проверять людей, у которых в системе электронных медицинских карт (EHR) записаны следующие показатели:
- возраст> 7 месяцев и <17 месяцев; и
- отсутствие гемоглобина или гематокрита в возрасте от 7 до 18 месяцев
Список литературы
- Центры по контролю и профилактике заболеваний.1998 г., 3 апреля. Рекомендации по профилактике и контролю дефицита железа в США. MMWR 47 (№ RR-3).
- Американская академия педиатрии, Комитет по питанию. 2003. Справочник по педиатрическому питанию (5-е изд.). Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии.
- Американская академия педиатрии, Комитет по психологическим аспектам здоровья детей и семьи. 1997. Руководство по надзору за здоровьем III. Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии.
- Профилактическая целевая группа США
Веб-ссылки
- http: // www.cdc.gov/mmwr/preview/mmwrhtml/00051880.htm
- http://www.aap.org
- http://www.ahcpr.gov/clinic/uspstf/uspsiron.htm
Замечания по реализации
Категория правил | Скрининг анемии |
|---|---|
Название правила | Требуется обследование на анемию |
Первичный клинический участок | Педиатрия |
Дополнительный клинический участок | |
Определение группы риска | Возраст> 7 месяцев и <17 месяцев |
Реквизиты группы риска | НЕТ |
Условие срабатывания | Гемоглобин или гематокрит не проводились в возрасте от 7 до 18 месяцев |
Детали для запуска | Проверить EHR на возраст и дату последнего определения гемоглобина или гематокрита |
Состояние | гемоглобин гематокрит |
Отображаемое сообщение | Пациент должен пройти обследование на анемию |
Кодированных ответов | Периоды повтора |
A: Сделано сегодня | A ‘: Forever |
Заявление об ограничении ответственности
Эти правила и / или напоминания были созданы с использованием национальных, региональных и местных правил, а также консенсуса группы в отношении передовой практики.Эти рекомендации и их интерпретация клиницистами в Partners Healthcare System не могут представлять собой стандарт оказания медицинской помощи для всех регионов или условий и не предназначены для принятия или применения без независимой оценки их пригодности для конкретных условий. Более того, рекомендации со временем меняются (например, возрастной диапазон для детей, которым следует делать прививки от гриппа, недавно был увеличен до 59 месяцев). Правила и / или напоминания могут потребовать добавления или изменения определенных элементов, чтобы обеспечить их соответствие текущим руководящим принципам.Поэтому приведенные здесь правила и / или напоминания предназначены только в качестве примеров или руководств для разработки аналогичных правил и / или напоминаний в других настройках. Partners Healthcare System и ее аффилированные лица не несут никакой ответственности или обязательств, связанных с использованием правил и / или напоминаний, отображаемых здесь третьими сторонами.
Анемия у детей из неблагополучных семей в возрасте до пяти лет; качество медицинской помощи в первичной практике | BMC Pediatrics
Маклин Э., Когсуэлл М., Эгли И., Войдила Д., де Бенуа Б. Распространенность анемии во всем мире, Информационная система ВОЗ по витаминам и минералам, 1993-2005 гг. Public Health Nutr. 2009. 12 (4): 444–54. https://doi.org/10.1017/S1368980008002401.
Артикул
PubMed
Google Scholar
Стивенс GA, Finucane MM, De-Regil LM, Paciorek CJ, Flaxman SR, Branca F, Pena-Rosas JP, Bhutta ZA, Ezzati M. Исследование модели воздействия на питание G.глобальные, региональные и национальные тенденции в концентрации гемоглобина и распространенности общей и тяжелой анемии у детей, беременных и небеременных женщин за 1995-2011 годы: систематический анализ репрезентативных данных для населения. Ланцет Glob Health. 2013; 1 (1): e16–25. https://doi.org/10.1016/S2214-109X(13)70001-9.
Артикул
PubMed
PubMed Central
Google Scholar
Christofides A, Schauer C, Zlotkin SH. Дефицит железа и распространенность анемии и связанные с ними этиологические факторы риска в коренных народах и общинах инуитов в северном Онтарио и Нунавуте.Может J Общественное здравоохранение. 2005. 96 (4): 304–7.
PubMed
Google Scholar
Sears D, Mpimbaza A, Kigozi R, Sserwanga A, Chang MA, Kapella BK, Yoon S, Kamya MR, Dorsey G, Ruel T. Качество стационарного педиатрического лечения четырех основных причин детской смертности в шесть государственных больниц Уганды. PLoS One 2015; 10 (5): 1–19.
Артикул
Google Scholar
Ewusie JE, Ahiadeke C, Beyene J, Hamid JS. Распространенность анемии среди детей в возрасте до 5 лет среди населения Ганы: оценки по демографическому обследованию и исследованию здоровья в Гане. BMC Public Health. 2014; 14 (1): 626. https://doi.org/10.1186/1471-2458-14-626.
Артикул
PubMed
PubMed Central
Google Scholar
Austin AM, Fawzi W, Hill AG. Анемия среди египетских детей в период с 2000 по 2005 год: тенденции и предикторы.Matern Child Nutr. 2012. 8 (4): 522–32. https://doi.org/10.1111/j.1740-8709.2011.00339.x.
Артикул
PubMed
Google Scholar
Xin QQ, Chen BW, Yin DL, Xiao F, Li RL, Yin T, Yang HM, Zheng XG, Wang LH. Распространенность анемии и ее факторы риска среди детей в возрасте до 36 месяцев в Китае. J Trop Pediatr. 2017; 63 (1): 36–42. https://doi.org/10.1093/tropej/fmw049.
Артикул
PubMed
Google Scholar
Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Железодефицитная анемия. Ланцет. 2016; 387 (10021): 907–16. https://doi.org/10.1016/S0140-6736(15)60865-0.
CAS
Статья
PubMed
Google Scholar
Khambalia AZ, Aimone AM, Zlotkin SH. Бремя анемии среди коренного населения. Nutr Rev.2011; 69 (12): 693–719. https://doi.org/10.1111/j.1753-4887.2011.00437.x.
Артикул
PubMed
Google Scholar
Мармот М. Социальные детерминанты и здоровье коренных австралийцев. Med J Aust. 2011. 194 (10): 512–3.
PubMed
Google Scholar
Балараджан Й., Рамакришнан У., Озалтин Э., Шанкар А.Х., Субраманиан С.В. Анемия в странах с низким и средним доходом. Ланцет. 2011. 378 (9809): 2123–35. https://doi.org/10.1016/S0140-6736(10)62304-5.
Артикул
PubMed
Google Scholar
Grantham-McGregor S, Ani C. Обзор исследований влияния дефицита железа на когнитивное развитие у детей. J Nutr. 2001; 131 (2S-2): 649S – 66S обсуждение 66S – 68S.
CAS
Статья
Google Scholar
Департамент здравоохранения. Оценка состояния здоровья аборигенов и жителей островов Торресова пролива (MBS Item 715). График льгот Medicare — Примечание AN.0.44. Канберра: Австралийское Содружество. http://www9.health.gov.au/mbs/fullDisplay.cfm?type=note&qt=NoteID&q=AN.0.44 Доступ 9 апреля 2016 г.
Bar-Zeev SJ, Kruske SG, Barclay LM, Bar-Zeev N, Kildea SV. Соблюдение руководящих принципов лечения задержек роста и анемии у детей-аборигенов Австралии, живущих в отдаленных районах, и препятствий на пути оказания медицинских услуг. BMC Health Serv Res. 2013; 13: 250. https://doi.org/10.1186/1472-6963-13-250.
Артикул
PubMed
PubMed Central
Google Scholar
Бейли Р.С., Си Д., О’Донохью Л., Дауден М. Здоровье коренного населения: эффективные и устойчивые услуги здравоохранения за счет постоянного улучшения качества. Med J Aust. 2007. 186 (10): 525–7.
PubMed
Google Scholar
Бейли Р., Си Д., Коннорс К., Вирамантри Т., Кларк Л., Дауден М., О’Донохью Л., Кондон Дж., Томпсон С., Клелланд Н. и др. Протокол исследования: аудит и передовой опыт проекта по распространению хронических заболеваний (ABCDE). BMC Health Serv Res.2008; 8: 184. https://doi.org/10.1186/1472-6963-8-184.
Артикул
PubMed
PubMed Central
Google Scholar
Бейли Р., Си Д., Шеннон С., Семменс Дж., Роули К., Скримджер Д. Д., Нагель Т., Андерсон И., Коннорс С., Вирамантри Т. и др. Протокол исследования: национальное научно-исследовательское партнерство с целью улучшения показателей и результатов первичной медико-санитарной помощи для коренных народов. BMC Health Serv Res. 2010; 10: 129. https://doi.org/10.1186/1472-6963-10-129.
Артикул
PubMed
PubMed Central
Google Scholar
Эдмонд К.М., Маколи К., Маколлей Д., Мэтьюз В., Штробел Н., Марриотт Р., Бейли Р. Качество услуг по социальному и эмоциональному благополучию для семей маленьких детей из числа коренных народов, посещающих центры первичной медицинской помощи; поперечный анализ. BMC Health Serv Res. 2018; 18 (1): 100. https://doi.org/10.1186/s12913-018-2883-6.
Артикул
PubMed
PubMed Central
Google Scholar
McAullay D, McAuley K, Bailie R, Mathews V, Jacoby P, Gardner K, Sibthorpe B, Strobel N, Edmond K. Постоянное участие в ежегодных мероприятиях по постоянному повышению качества улучшает качество ухода за детьми аборигенов и жителей островов Торресова пролива. J Педиатр детского здоровья. 2018; 54 (2): 132–40. https://doi.org/10.1111/jpc.13673.
Артикул
PubMed
Google Scholar
Департамент здравоохранения. Сбор крови уколом пятки.В: Здоровье детей и подростков, под ред. Западная Австралия: Служба здоровья детей и подростков, Министерство здравоохранения; 2016.
NACCHO / RACGP. Национальное руководство по профилактической оценке здоровья аборигенов и жителей островов Торресова пролива. 2-е изд. Южный Мельбурн: RACGP; 2012. http://www.naccho.org.au/download/aboriginal-health/1.National%20guide%20to%20a%20preventive%20health%20assessment%20for%20Aboriginal%20and%20Torres%20Strait%20Islander%20people% 20% 282% 29.pdf Доступ 8 апреля 2016 г.
Google Scholar
Совет по медицинским услугам для аборигенов Кимберли (KAMSC), Страновая служба здравоохранения штата Вашингтон (WACHS) Кимберли. Здоровые дети. 2011.
Google Scholar
Совет по медицинским услугам для аборигенов Кимберли (KAMSC), Служба здравоохранения штата Вашингтон (WACHS), Кимберли. Анемия у детей. 2015.
Google Scholar
Queensland Health. Интернет: https://www.health.qld.gov.au/rrcsu/html/health-check-forms По состоянию на 20 апреля 2016 г.
Queensland Health. Королевская служба летающих врачей (секция Квинсленда). Руководство по первичной клинической помощи 9-е издание. Кэрнс: Сельское и удаленное отделение клинической поддержки, Больница и Служба здравоохранения Торрес и Кейп; 2016.
Google Scholar
Руководства по дистанционной первичной медико-санитарной помощи. Стандартное руководство по лечению CARPA.7-е изд. Алис-Спрингс: Центр удаленного здоровья; 2017.
Google Scholar
ВОЗ. Концентрация гемоглобина для диагностики анемии и оценки степени тяжести. Информационная система о витаминном и минеральном питании. Женева: Всемирная организация здравоохранения; 2011. 2011 (WHO / NMH / NHD / MNM / 11.1)
Google Scholar
Департамент здравоохранения и ухода за престарелыми Содружества.Измерение удаленности: Индекс доступности / удаленности Австралии (ARIA). Пересмотренное издание: «Случайные статьи: новая серия, номер 14»; 2001. Канберра.
Bogen DL, Krause JP, Serwint JR. Исход детей с анемией при плановом обследовании в городской поликлинике. Arch Pediatr Adolesc Med. 2001. 155 (3): 366–71. https://doi.org/10.1001/archpedi.155.3.366.
CAS
Статья
PubMed
Google Scholar
Bogen DL, Duggan AK, Dover GJ, Wilson MH. Скрининг железодефицитной анемии по анамнезу питания в популяции высокого риска. Педиатрия. 2000. 105 (6): 1254–9.
CAS
Статья
Google Scholar
Gessner BD. Географические и расовые особенности распространенности анемии среди детей из малообеспеченных семей Аляски и беременных или послеродовых женщин ограничивают потенциальную этиологию. J Педиатр Гастроэнтерол Нутр. 2009. 48 (4): 475–81. https: // doi.org / 10.1097 / MPG.0b013e3181888fac.
Артикул
PubMed
Google Scholar
Грейси М., Кинг М. Здоровье коренного населения, часть 1: детерминанты и характер заболеваний. Ланцет. 2009. 374 (9683): 65–75. https://doi.org/10.1016/S0140-6736(09)60914-4.
Артикул
PubMed
Google Scholar
АБС. Продовольственная безопасность. Канберра: ABS; 2015.
Google Scholar
Hipgrave DB, Fu X, Zhou H, Jin Y, Wang X, Chang S, Scherpbier RW, Wang Y, Guo S. Плохая практика прикорма и высокая распространенность анемии среди детей грудного и раннего возраста в сельских районах центрального и западного Китая. Eur J Clin Nutr. 2014; 68 (8): 916–24. https://doi.org/10.1038/ejcn.2014.98.
CAS
Статья
PubMed
Google Scholar
Вирт Дж. П., Ронер Ф., Вудрафф Б.А., Чивил Ф., Янксон Х., Корома А.С., Рассел Ф., Сесей Ф., Домингес Э., Петри Н. и др.Анемия, дефицит питательных микроэлементов и малярия у детей и женщин в Сьерра-Леоне до вспышки Эболы — результаты перекрестного исследования. PLoS One. 2016; 11 (5): e0155031. https://doi.org/10.1371/journal.pone.0155031.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ayoya MA, Ngnie-Teta I, Séraphin MN, Mamadoultaibou A, Boldon E, Saint-Fleur JE, Koo L, Bernard S. Распространенность и факторы риска анемии среди детей в возрасте 6–59 месяцев на Гаити.Анемия. 2013; 2013. https://doi.org/10.1155/2013/502968.
Артикул
Google Scholar
Австралийский институт здравоохранения и социального обеспечения. Здоровье Австралии, 2016. Серия статей о здоровье Австралии, № 15. Кат. нет. AUS 199. Канберра: AIHW; 2016.
Google Scholar
Бейли Р.С., Си Д., Дауден М.К., Коннорс С.М., О’Донохью Л., Лиддл Х.Э., Кеннеди С.М., Кокс Р.Дж., Берк HP, Томпсон С.К. и др.Предоставление услуг по охране здоровья детей в общинах коренных народов: последствия для чрезвычайного вмешательства федерального правительства в Северной территории. Med J Aust. 2008. 188 (10): 615–8.
PubMed
Google Scholar
McLennan JDS, M. Результаты скрининга и лечения анемии у детей в сообществе с ограниченными ресурсами в Доминиканской Республике. J Trop Pediatr. 2016; 62: 116–22.
Артикул
Google Scholar
Crowell R, Pierce MB, Ferris AM, Slivka H, Joyce P, Bernstein BA, Russell-Curtis S. Управление анемией у детей ясельного возраста: препятствия, проблемы и контекст в первичной медико-санитарной помощи. J Здравоохранение Плохо обслуживается. 2005. 16 (4): 791–807. https://doi.org/10.1353/hpu.2005.0092.
Артикул
PubMed
Google Scholar
Кемпе А., Бити Б., Энглунд Б. П., Рорк Р. Дж., Хестер Н., Штайнер Дж. Ф. Качество ухода и использование медицинского дома в рамках финансируемого государством плана первичной медико-санитарной помощи для детей с низкими доходами.Педиатрия. 2000; 105: 1020–8.
CAS
Статья
Google Scholar
Биондик П.Г., Даунс С.М., Кэрролл А.Е., Ласки А.Л., Лю Г.К., Розенман М., Ван Дж., Свигонски Н.Л. Недостатки методов скрининга на дефицит железа у младенцев. Педиатрия. 2006. 117 (2): 290–4. https://doi.org/10.1542/peds.2004-2103.
Артикул
PubMed
Google Scholar
Ware V. Улучшение доступа к городским и региональным услугам для детей младшего возраста.Информационный лист № 17. Создан для устранения разрыва в расчетной палате. Cnberra: Австралийский институт здоровья и социального обеспечения, Мельбурн: Австралийский институт семейных исследований, 2012.
Мэтьюз В., Ширхаут Дж., Макбрум Дж., Коннорс С., Кеннеди С., Кведза Р., Ларкинс С., Мур Э, Томпсон С., Скримджер Д. и др. Продолжительность участия в постоянном улучшении качества: ключевой фактор, объясняющий улучшение предоставления услуг при диабете 2 типа. BMC Health Serv Res. 2014; 14: 578. https: // doi.org / 10.1186 / s12913-014-0578-1.
Артикул
PubMed
PubMed Central
Google Scholar
О’Грейди К.А., Краузе В., Эндрюс Р. Охват иммунизацией детей коренных народов Австралии: пора переставить стойки ворот. Вакцина. 2009. 27 (2): 307–12. https://doi.org/10.1016/j.vaccine.2008.09.096.
Артикул
PubMed
Google Scholar
Бейли Р.С., Си Д., Коннорс С.М., Кведза Р., О’Донохью Л., Кеннеди С., Кокс Р., Лиддл Х., Хейнс Дж., Дауден М.К. и др.Различия в качестве профилактического ухода для здоровых взрослых в медицинских центрах коренных жителей Австралии. BMC Health Serv Res. 2011; 11: 139. https://doi.org/10.1186/1472-6963-11-139.
Артикул
PubMed
PubMed Central
Google Scholar
Акино Д., Марли Дж., Старший К., Леонард Д., Джошуа А., Хаддлстон А., Фергюсон Н., Хелмер Дж., Хэдграфт Н., Хобсон В. Проект питания и профилактики анемии в раннем детстве Дарвин: Фонд Фреда Холлоуса, Программа для коренных народов Австралии; 2013.
Google Scholar
Штробель Н.А., Маколи К., Мэтьюз В., Ричардсон А., Агостино Дж., Эдмонд К. Э., Маколлей Д. Понимание структуры и процессов оказания первичной медико-санитарной помощи маленьким детям из числа коренных народов. J Prim Health Care. 2018; 10: 267–78.
Артикул
Google Scholar
Коэн А.Р., Зейдл-Фридман Дж. Система HemoCue для измерения гемоглобина.Оценка у детей с анемией и без анемии. Am J Clin Pathol. 1988. 90 (3): 302–5.
CAS
Статья
Google Scholar
Миллс А.Ф., Медоуз Н. Скрининг анемии: оценка гемоглобинометра. Arch Dis Child. 1989. 64 (10): 1468–71.
CAS
Статья
Google Scholar
Анемия | Педиатрия | Чикагский университет
Вы посещаете девятимесячного мужчину для регулярного осмотра.У него в вашем офисе гематокрит 28%.
Как бы вы оценили анемию у этого пациента?
Определение анемии
Вы правильно определили, что у этого пациента анемия. Анемия обычно определяется как уровень гемоглобина (Hb) или гематокрита (Hct), который более чем на два стандартных отклонения ниже среднего значения для контрольной популяции. При оценке анемии важно учитывать нормальный диапазон значений с учетом возраста, пола и расы ребенка (см. Таблицу ниже).
Гемоглобин, гематокрит, эритроциты, средний корпускулярный объем и лейкоциты у детей 1-14 лет, по возрастным группам и полу:
Гемоглобин (г / дл)
Мужской | Женский | ||||||||||||||||||||||||
Среднее значение | SD | 95% ДИ | Среднее | SD | 95% ДИ | ||||||||||||||||||||
1-2 года | 12.01 | 0,82 | 10,37 | 13,65 | 12,02 | 0,80 | 10,42 | 13,62 | |||||||||||||||||
3-5 лет | 12,35 | 0,77 | 10.81 | 13,89 | 12,39 | 0,77 | 10,85 | 13,93 | |||||||||||||||||
6-8 лет | 12,88 | 0,80 | 11,28 | 14,48 | 12.82 | 0,77 | 11,28 | 14,36 | |||||||||||||||||
9-11 лет | 13,28 | 0,84 | 11,60 | 14,96 | 13,10 | 0,78 | 11.54 | 14,66 | |||||||||||||||||
12-14 лет | 14,14 | 1.08 | 11,98 | 16,30 | 13,29 | 1,00 | 11,29 | 15,29 | |||||||||||||||||
15-19 лет | 15.07 | 1.03 | 13,01 | 17,13 | 13,15 | 1,00 | 11,15 | 15,15 | |||||||||||||||||
Гематокрит (%)
| |||||||||||||||||||||||||
1-2 года | 36 | 2 | 32 | 40 | 36 | 2 | 32 | 40 | |||||||||||||||||
3-5 лет | 37 | 2 | 33 | 41 | 37 | 2 | 33 | 41 | |||||||||||||||||
6-8 лет | 38 | 2 | 34 | 42 | 38 | 2 | 34 | 42 | |||||||||||||||||
9-11 лет | 39 | 2 | 35 | 43 | 39 | 2 | 35 | 43 | |||||||||||||||||
12-14 лет | 42 | 3 | 36 | 48 | 40 | 3 | 34 | 46 | |||||||||||||||||
15-19 лет | 45 | 3 | 39 | 51 | 39 | 3 | 33 | 45 | |||||||||||||||||
* 95% доверительный интервал (+/- 2 SD) определяет нормальный диапазон и соответствует 2.С 5-го по 97,5-й процентили.
История
- Серьезность и возникновение симптомов
- Вялость
- Тахикардия
- Бледность
- Раздражительность
- Плохое пероральное поступление
- Симптомы, которые обычно наблюдаются при хронической анемии, отсутствуют, тогда как острая анемия имеет тенденцию быть более симптоматичной
- Свидетельства гемолитических эпизодов
- Изменения цвета мочи
- Желтуха склеры
- Желтуха
- Гемолитические эпизоды только у членов семьи мужского пола могут указывать на Х-сцепленное расстройство (например,г. G6PD)
- Предыдущее лечение или эпизоды анемии
- Предыдущие эпизоды анемии, продолжительность, этиология и разрешение
- Предыдущее лечение анемии (например, неэффективное лечение железом)
- Кровопотеря
- Желудочно-кишечное кровотечение: изменение цвета стула, кровь в стуле, симптомы со стороны кишечника
- Менструальные потери: продолжительность менструации, поток и насыщение тампонов или прокладок
- Тяжелое носовое кровотечение
- При значительной кровопотере исследуйте семейный анамнез на предмет воспалительного заболевания кишечника, полипов, колоректального рака, наследственной геморрагической телеангиэктазии, болезни фон Виллебранда, нарушений тромбоцитов и гемофилии
- Основные медицинские условия
- Хронические основные инфекционные или воспалительные состояния
- Недавние болезни
- Путешествие в районы эндемической инфекции и обратно (например,г. малярия)
- Предыдущее воздействие наркотиков или токсинов
- Воздействие токсинов в окружающей среде (например, колодезная вода, содержащая нитраты)
- Гомеопатические или растительные препараты
- Риск воздействия свинца: жилье, краска, материалы для приготовления пищи, керамические горшки с плохой глазурью
- Диета
- Потребление железа
- Формула (формулы с железом содержат примерно 12 мг / л и должны применяться в течение 12 месяцев)
- Прием молока и время прекращения приема
- Грудное молоко — достаточный источник железа в течение 6 месяцев без каких-либо добавок
- Только около 10% железа в цельном молоке доступно для абсорбции, и это может вызвать желудочно-кишечное кровотечение и потерю железа
- Злаки, зелень и мясо (хороший источник железа для детей старшего возраста)
- Аскорбиновая кислота (увеличивает абсорбцию пищевого железа)
- Потребление B12 / фолиевой кислоты (менее важно, чем железо)
- Pica: поедание грязи, стружки краски и любых необычных веществ (часто связанных с дефицитом железа)
- Потребление железа
- История рождений
- Гестационный возраст при рождении
- У недоношенных детей меньше запасов железа, и они быстрее растут, требуя дополнения их рациона железом, тогда как доношенные дети имеют достаточно запасов железа на 4 месяца
- Недоношенные дети могут иметь дефицит железа или витамина Е, что приводит к анемии
- Значительная потеря крови при рождении (может повлиять на количество запасов железа)
- Обменная или внутриматочная трансфузия в анамнезе
- Желтуха или необходимость в фототерапии (может указывать на наследственную гемолитическую анемию)
- Микроцитоз при рождении (может указывать на хроническую внутриутробную кровопотерю и альфа-талассемию)
- Гестационный возраст при рождении
- История роста / развития
- Нормальный рост и прибавка в весе обычно исключают хроническое заболевание как этиологию анемии
- Потеря основных этапов развития или задержка в развитии (у младенца с мегалобластной анемией может указывать на дефект B12 или путей фолиевой кислоты)
- Семейная история
- История анемий
- Спленэктомии
- Серповидно-клеточная анемия
- Дефицит G6PD
- Холелитиаз
- Переливания
- Раса / этническая принадлежность
- Средиземноморье и Юго-Восточная Азия: талассемии
- Чернокожие и латиноамериканцы: Hb S и C
- Сефардские евреи, филиппинцы, греки и курды: дефицит G6PD
Физический осмотр
- GEN: Признаки хронического заболевания
- HEENT: Бледность конъюнктивы, глоссит (связанный с B12 и дефицитом железа), лобная выпуклость (наблюдается при талассемии)
- CV: Частота сердечных сокращений и наличие шума
- ABD : Гепатомегалия (злокачественные новообразования, экстрамедуаллярное кроветворение, хронические заболевания), спленомегалия (гемолитические анемии, ОЛЛ, лимфомы, экстрамедуллярное кроветворение)
- ЛИМФА: Значительная аденопатия (лейкемии и лимфомы, хронические заболевания, ВИЧ)
- КОЖА: Петехии, пурпура, желтуха, гемангиомы
- EXTR: Радиальные аномалии (связанные с врожденными анемиями, например.г. Анемия Фанкони)
Терапевтическое испытание железа
Если физикальный осмотр, анамнез и диетический анамнез указывают на дефицит железа, рекомендуется терапевтическое испытание железа (6 мг / кг / день) перед тем, как приступить к обширной лабораторной оценке. Гематокрит следует перепроверить через месяц.
Если наблюдается повышение гематокрита как минимум на три процентных пункта (или повышение Hgb на 1 г / дл), диагноз — дефицит железа, и пациента следует лечить железом еще в течение двух месяцев.Родителям необходимо дать совет по диете.
Если есть , а не — значительный рост гематокрита, необходима дальнейшая оценка:
Начальные лабораторные исследования
Общий анализ крови с дифференциалом
- Средний корпускулярный объем (MCV): микро- против нормо- против макроцитоза
- Ширина распределения эритроцитов (RDW): оценивает анизоцитоз (норма — 11.5-14,5), обычно повышается при дефиците железа
- Лейкопения, нейтропения и / или тромбоцитопения могут указывать на нарушение функции костного мозга или повышенное периферическое разрушение клеток крови
- Число ретикулоцитов: показатель эритропоэтической активности костного мозга
- Мазок клеток крови
- Размер эритроцитов: микроцитоз vs. макроцитоз
- Центральная бледность: усиление центральной бледности (дефицит железа и талассемия) или ее отсутствие (сфероциты и ретикулоциты)
- Фрагментированные клетки (микроангиопатический процесс)
- Серповидно-клеточная анемия (серповидноклеточная анемия)
- Эллиптоциты (врожденный эллиптоцитоз)
- Клетки-мишени (талассемия, при заболеваниях печени и после спленэктомии)
- Прикусные клетки (гемолитическая анемия с тельцами Хайнца)
,00
,00
,00
Результаты первоначального тестирования послужат основой для дополнительной работы.
Список литературы
- Бэйн Б. Диагноз по мазку крови. NEJM 353; 5 Pg 498 4 августа 2005 г.
- Crocetti M et al. Преходящая эритропения в детстве: прислушиваясь к тихой анемии. Современная педиатрия, апрель 2002 г.
- [Таблица] Hollowell JG et al. Гематологические и справочные данные по аналитам, связанным с железом, для лиц в возрасте от 1 года и старше: США, 1988-94 гг. Vital Health Stat 2005; 11: 1.
- Оски Ф.Дефицит железа в младенчестве и детстве. NEJM Vol. 329 No. 3 190-193 1993.
- Ричардсон, Мэтью. Микроцитарная анемия. Педиатрия в обзоре 28.1 (2007): 5-14.
- Робинс Е.Б. и соавт. Гематологические контрольные значения для афроамериканских детей и подростков. Am J Hematol. 2007; 82 (7): 611.
- Саки К. Гемолитическая анемия: Часть 1. Обзор педиатрии. 1999; 20: 152-159.
- Саки К. Гемолитическая анемия: Часть 2. Обзор педиатрии. 1999; 20: 204-208.
- Кетт, Дженнифер Кобелли. Анемия в младенчестве. Педиатрия в обзоре 33.4 (2012): 186-187.
- Segel G et al. Управление анемией в педиатрической практике. Часть 1. Педиатрия в Рейвью. Март 2002.
- Segel G et al. Управление анемией в педиатрической практике. Часть 2. Педиатрия в обзоре. Апрель 2002.
- Shah S et al. Наследственный сфероцитоз. Педиатрия в обзоре. Май 2004.
- Келли Н. Талассемия. Педиатрия в обзоре Сентябрь 2012 г.
.
.
.
Вернуться к содержанию
Обзор для основного поставщика медицинских услуг
Гемовые / онкологические состояния при синдроме Дауна (СД) встречаются редко и наблюдаются только у 1-2% людей с СД.Однако последствия могут быть серьезными. В этом документе будет рассмотрен спектр связанных гем / онкологических состояний, а также важные рекомендации по скринингу.
Каковы наиболее частые ассоциации гема / рака с синдромом Дауна?
Преходящее миелопролиферативное заболевание (ВНЧС)
- ВНЧС развивается примерно у 1 из 10 младенцев с СД и встречается почти исключительно у новорожденных с СД. ВНЧС — это нарушение, по крайней мере, одной линии кроветворных клеток, которое, как считается, происходит из-за нарушения производства клеток крови фетальной печени.
- Обнаружена клональная популяция бластов, часто вместе с анемией и / или тромбоцитопенией.
- Менеджмент обычно поддерживает переливание крови по мере необходимости.
- Лейкаферез рекомендуется, если количество лейкоцитов> 200k. Проведение цитотоксической терапии противоречиво и в высшей степени индивидуализировано.
- Иногда требуется кратковременное лечение низкими дозами цитотоксической терапии.
- Хотя ВНЧС чаще всего протекает доброкачественно со спонтанным разрешением к 3-месячному возрасту, у пораженных новорожденных могут развиваться опасные для жизни осложнения, включая водянку, гепатоспленомегалию и кожные или органные инфильтраты.
- Кроме того, у 10–30 процентов детей с ВНЧС разовьется лейкемия (чаще всего острый мегакариобластный лейкоз (AMKL) в более позднем возрасте. Это тип ОМЛ. Таким образом, ВНЧС считается предлейкемическим заболеванием, требующим тщательного гематологического наблюдения. вверх (общий анализ крови с разницей каждые 3 месяца до 3 лет, а затем каждые 6 месяцев до 6 лет).
Полицитемия
- Около 65 процентов младенцев с трисомией 21 имеют полицитемию (венозный гематокрит> 65%) в первые несколько месяцев жизни.
- Это происходит даже у детей без цианотических пороков сердца и считается вторичным по отношению к повышенному уровню эритропоэтина на фоне хронической гипоксемии плода.
- Полицитемия обычно проходит сама по себе; Частичное обменное переливание является спорным, но может быть показано, если гематокрит> 70%.
Железодефицитная анемия
- Уровень гемоглобина следует измерять ежегодно от 1 до 21 года для скрининга на анемию.
- Дефицит железа является наиболее частой этиологией анемии у детей с СД (как и во всем мире).Это связано с пониженным потреблением железа с пищей из-за гипотонии, дисфагии и задержки оральной моторики.
Острый лейкоз
- Дети и взрослые с СД в 10-20 раз чаще заболевают острым лейкозом. Однако, поскольку лейкемия в целом встречается довольно редко, только у 1–1,5 процента людей с DS разовьется лейкемия. Лимфобластная и миелобластическая формы встречаются одинаково.
- Острый миелоидный лейкоз, как правило, возникает в возрасте от 1 до 5 лет. Подтип AKML является наиболее распространенным среди детей с DS.Ген GATA1, расположенный на хромосоме 21, кодирует гемопоэтический фактор роста. Было показано, что GATA1 участвует в патогенезе как TMD, так и AKML у детей с DS, а также в лейкозных бластах пациентов без DS. Дети с ОМЛ, связанным с СД, имеют более низкую частоту рецидивов и улучшенную чувствительность к стандартной химиотерапии по сравнению с детьми без СД.
- Острый лимфоидный лейкоз (ОЛЛ) обычно наблюдается в возрасте от 3 до 6 лет у детей с СД. Представление ALL в DS аналогично представлению ALL не в DS.Однако дети с ОЛЛ, связанным с СД, как правило, более чувствительны и предрасположены к токсичности от терапии метотрексатом (считается, что разница в метаболизме связана с ферментами, кодируемыми на хромосоме 21). В отличие от детей с ОМЛ, у детей с СД, у которых развивается ОЛЛ, прогноз хуже, чем у детей без СД.
Опухоли зародышевых клеток
- У людей с синдромом DS в 5-50 раз больше случаев рака яичек, особенно опухолей половых клеток. Хотя крипторхизм считается фактором риска, этиология повышенного риска до конца не изучена.
Какие виды рака менее вероятны для людей с синдромом Дауна?
Люди с СД, как правило, имеют более низкую заболеваемость большинством солидных опухолей, в частности: опухоли ЦНС и периферических нервов, нейробластомы и опухоли Вильмса, а также карциномы бронхов, носоглотки, мочевыводящих путей, матки, груди и кожи.
Насколько надежны типичные гематологические показатели при синдроме Дауна?
- MCV эритроцитов у детей с DS имеет тенденцию к повышению.Точная патофизиология и этиология неизвестны, но считается, что они связаны с прямым присутствием дополнительной хромосомы 21, а не с каким-либо суррогатом, таким как болезнь сердца или гематокрит. Это делает MCV плохим показателем для диагностики железодефицитной анемии у детей с СД.
- Количество лейкоцитов при СД часто низкое. Низкое количество тромбоцитов бывает редко и должно вызывать беспокойство.
Как часто следует проверять общий анализ крови и / или гемоглобин?
Рекомендации AAP рекомендуют проводить скрининг новорожденных с СД с помощью общего анализа крови и дифференциала для оценки миелопролиферативных нарушений, полицитемии, анемии и тромбоцитопении.Затем в рекомендациях AAP предлагается ежегодный скрининг на гемоглобин. Если есть опасения по поводу диеты с низким содержанием железа или если гемоглобин <11, рекомендуется назначить ферритин и CRP или ретикулоцитарный гемоглобин, поскольку MCV может быть ненадежным предиктором. Если CRP повышен, то ферритин ненадежен, поскольку оба могут быть реагентами острой фазы.
На какие признаки и симптомы следует обращать внимание родителей?
- Избыточная утомляемость
- Летаргия
- Существенное изменение схемы кормления
- Одышка
- Легкие синяки
- Петехии
- Боль в ногах
- хромает
Ред .: 7/2012. Эта веб-страница предназначена для предоставления медицинской информации, чтобы вы могли быть лучше информированы. Он не заменяет рекомендации врача и не должен использоваться для лечения каких-либо заболеваний.
Распространенность и предикторы железодефицитной анемии у детей в возрасте до пяти лет в Пакистане, вторичный анализ данных национального исследования питания, 2011–2012 гг.
Аннотация
Фон
Железодефицитная анемия (ЖДА) у детей — это признанная проблема общественного здравоохранения, которая отрицательно влияет на заболеваемость, смертность детей и ухудшает когнитивное развитие.В Пакистане информация об истинной распространенности и предикторах ЖДА ограничена. Это исследование было направлено на изучение ЖДА у детей в возрасте до пяти лет с использованием данных национального репрезентативного стратифицированного поперечного исследования.
Методы
Вторичный анализ проводился в рамках Национального исследования питания в Пакистане за 2011–2012 гг. Мы использовали предварительно структурированный инструмент для сбора социально-демографических данных и данных о питании матерей и детей. Мы также собрали антропометрические измерения и образцы крови на предмет дефицита питательных микроэлементов.Было определено, что IDA имеет как уровни гемоглобина <110 г / л, так и уровни ферритина <12 мкг / л. Анализ данных проводился с применением одномерных и многомерных методов с использованием логистической регрессии через SPSS.
Выводы
Всего в анализ было включено 7138 детей в возрасте от 6 до 59 месяцев. Распространенность ЖДА составила 33,2%. В многомерном регрессионном анализе были рассчитаны скорректированные отношения шансов (AOR). Возраст <24 месяцев (AOR 1,40, 95% ДИ 1,18–1,55 p <0.05), задержка роста (AOR 1,42 CI 1,23–1,63 p <0,05), наличие клинической анемии (AOR 5,69 CI 4,93-6,56 p <0,05), наличие у матери ЖДА (AOR 1,72 CI 1,47–2,01 p <0,05) и домохозяйство отсутствие продовольственной безопасности (AOR 1,20 CI 1,10–1,40 P <0,05) было связано с ЖДА. Проживание в сельской местности (AOR 0,77 CI 0,65–0,90 p <0,05) и принадлежность к женскому полу (AOR 0,87 CI 0,76–0,98 p <0,05) были связаны с уменьшением вероятности ЖДА.
Заключение
Распространенность ЖДА среди пакистанских детей представляет собой умеренное бремя, которое непропорционально затрагивает самых маленьких детей с задержкой роста, у пострадавших детей больше шансов иметь матерей с ЖДА и они живут в районах, где отсутствует продовольственная безопасность.Национальные усилия по облегчению бремени МАР должны включать как краткосрочные вертикальные программы, такие как добавление железа, так и долгосрочные горизонтальные программы, включая обогащение пшеничной муки.
Образец цитирования: Habib MA, Black K, Soofi SB, Hussain I., Bhatti Z, Bhutta ZA, et al. (2016) Распространенность и предикторы железодефицитной анемии у детей в возрасте до пяти лет в Пакистане, Вторичный анализ данных национального обследования питания, 2011–2012 гг. PLoS ONE 11 (5):
e0155051.https://doi.org/10.1371/journal.pone.0155051
Редактор: Франсуа Блашье, Национальный институт агрономических исследований, ФРАНЦИЯ
Поступила: 20 ноября 2015 г .; Одобрена: 22 апреля 2016 г .; Опубликовано: 12 мая 2016 г.
Авторские права: © 2016 Habib et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Данные национального обследования питания Пакистана, 2011 г., доступны на сайте www.data.org.pk.
Финансирование: Национальное исследование питания финансировалось ЮНИСЕФ. MAH является аспирантом Сиднейского университета и финансируется за счет международной стипендии для аспирантов и австралийской премии для аспирантов, финансируемой Министерством промышленности Содружества Австралии; и финансирование CRG через стипендию NHMRC по развитию карьеры.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Железодефицитная анемия у детей раннего возраста признана серьезной проблемой общественного здравоохранения и наиболее распространенной формой дефицита питательных микроэлементов во всем мире [1, 2]. Глобальная распространенность анемии (определяемая как уровень гемоглобина <110 г / л) у детей в возрасте 6-59 месяцев составляет 43%, и половина из них связана с железодефицитной анемией (ЖДА), которая определяется как уровень гемоглобина <110 г / л и уровень ферритина <12 мкг / л [1–4].ЖДА в значительной степени способствует детской смертности и заболеваемости и связана с нарушением развития мозга и когнитивных функций [5–9]. МАР также считается третьей ведущей причиной инвалидности в мире и 13 -м ведущим фактором риска для глобальных лет жизни с поправкой на инвалидность [10]. Большая часть бремени МАР лежит в странах с ограниченными ресурсами в Африке и Азии [4, 11].
Сообщается, что в Пакистане распространенность ЖДА у детей в возрасте до пяти лет составляет 40–70% [12–16].У пакистанских детей ЖДА ассоциируется с задержкой роста, нарушением когнитивных функций, снижением физической активности и считается одной из причин высокого национального уровня младенческой смертности [10, 12, 14, 17, 18, 19]. Широко распространенный дефицит питательных микроэлементов наряду с другими клиническими и социальными факторами считается основной причиной ЖДА в Пакистане [13–18]. Однако данных о распространенности мало, так как многие исследования проводятся более десяти лет назад или основаны на небольшом количестве и в небольших нерепрезентативных популяциях.Кроме того, ЖДА лучше всего определять как комбинацию как низкого гемоглобина, так и низких концентраций ферритина, тогда как опубликованные на сегодняшний день исследования в Пакистане в основном основаны исключительно на концентрациях гемоглобина.
Таким образом, до сих пор отсутствуют надежные репрезентативные данные на национальном уровне для определения социально-демографических факторов, связанных с ЖДА, которые позволят разработать местные стратегии лечения и профилактики ЖДА у пакистанских детей. В этом исследовании мы стремились оценить распространенность ЖДА у пакистанских детей и оценить факторы, связанные с ЖДА, путем проведения вторичного анализа Национального исследования питания Пакистана, которое проводилось в период с 2011 по 2012 гг.
Материалы и методы
Источник данных
Данные, использованные для этого анализа, были получены из Национального обзора питания Пакистана за 2011–2012 гг. Опрос был проведен Университетом Ага Хана (AKU) в сотрудничестве с Федеральным министерством здравоохранения Пакистана и финансировался ЮНИСЕФ. Обследование представляло собой стратифицированное репрезентативное межсекторное национальное обследование с провинциальной спецификой и двухэтапным планом стратифицированной выборки. Основа выборки в виде счетных блоков (числом 1500) была предоставлена Федеральным статистическим бюро Пакистана.Каждый счетный блок был размечен, нанесен на карту и внесен в список до фактического сбора данных, и из каждого счетного блока случайным образом с помощью компьютерной программы было выбрано 20 домохозяйств. Всего было включено 30 000 домашних хозяйств, 12 360 из них — городские, а 17 640 — сельские, что составляет 27 963 респондента. В исследование были включены домохозяйства с детьми в возрасте от шести месяцев до пяти лет. Из каждого отобранного домохозяйства была выбрана одна замужняя женщина репродуктивного возраста (15–49 лет), имеющая хотя бы одного ребенка в возрасте до 5 лет.Если в домохозяйстве было несколько подходящих женщин, случайным образом выбиралась одна женщина.
Для сбора данных использовался предварительно структурированный и протестированный инструмент. Инструмент собирал данные о социально-экономическом статусе, репродуктивном анамнезе матери, истории болезни ребенка, продовольственной безопасности, антропометрических измерениях и биохимических измерениях различных питательных микроэлементов. Для антропометрических измерений вес измерялся с помощью легких весов SECA, разработанных и изготовленных под руководством Детского фонда Организации Объединенных Наций (ЮНИСЕФ), а рост / длина измерялись с помощью досок для измерения роста производства Shorr Inc.Детей младше 2 лет измеряли в положении лежа на доске, а у детей старшего возраста измеряли рост стоя [20].
У детей старше 2 лет были рассчитаны z-баллы роста к возрасту (HAZ), z-баллы веса к возрасту (WAZ), z-баллы веса к росту (WHZ), а для детей младше 2 лет были рассчитаны используется вместо роста для расчета z-баллов длины тела к возрасту (LAZ) и отношения веса к длине тела z-баллов (WLZ). Индекс массы тела (ИМТ) был рассчитан для матерей с использованием роста и веса.Согласно классификации ВОЗ, у детей отмечалась задержка роста, истощение или недоедание, а у матерей — недостаточный, избыточный вес или ожирение [21]. Образцы крови для измерения гемоглобина и дефицита питательных микроэлементов были собраны у одного ребенка в каждом доме. Венозную кровь собирали и сыворотку отделяли в течение получаса после сбора, используя портативные центрифуги с резервным питанием. Гемоглобин измерялся в венозной крови в полевых условиях, в то время как образцы сыворотки доставлялись в лабораторию исследования питания Университета Ага Хана в условиях холодовой цепи через национальную сеть центров сбора лабораторий AKU.
Концентрация ферритина в сыворотке была измерена на предмет дефицита железа, поскольку он обладает самой высокой чувствительностью и специфичностью для выявления дефицита железа у людей [22]. Уровни ферритина были скорректированы для альфа (1) -кислотного гликопротеина (AGP) и С-реактивного белка (CRP), чтобы учесть, что ферритин является белком острой фазы и его уровень повышается при воспалительных состояниях [23–24]. Ферритин сыворотки измеряли с помощью электрохемилюминесцентного иммуноанализа с использованием химического анализатора Roche Cobas E41, а концентрацию гемоглобина в цельной крови измеряли с помощью микрокюветы, содержащей систему сухих реагентов и двухволновой фотометр HemoCue 201.Концентрация гемоглобина была также скорректирована для высот более 1000 метров с использованием рекомендованной ВОЗ формулы высоты [25]. Образцы крови также были проанализированы на дефицит цинка и витамина А. Сыворотка использовалась для оценки дефицита цинка и витамина А, и образцы были проанализированы с использованием спектрофотометрического метода на предмет дефицита цинка и метода обращенно-фазовой хроматографии на недостаток витамина А.
Все мероприятия по обследованию контролировались для обеспечения качества данных. Анкета была предварительно протестирована перед внедрением на местах, а также был проведен пилотный опрос.Компетентность полевого персонала также принималась во внимание перед приемом на работу, а предварительное и последующее тестирование проводилось для всего полевого персонала во время обучения. В обследовании использовались внутренние и внешние мониторы данных для обеспечения качества данных в отношении всех процедур и мероприятий обследования. Антропометрия и оборудование HemoCue ежедневно калибровались на предмет возможных ошибок. Руководители групп проанализировали данные (проверки правдоподобия и предпочтение цифр) с помощью программного обеспечения ENA Smart и регулярно предоставляли отзывы для улучшения.Подобные шаги по обеспечению качества были должным образом учтены при вводе и очистке данных.
Этическое одобрение исследования было получено от Комитета по этике Университета Ага Хана и Национального комитета по биоэтике Пакистана. Письменное информированное согласие было получено от матерей выбранного ребенка. В случае неграмотной матери согласие подтверждалось отпечатком большого пальца на бланке согласия и подписью грамотного свидетеля. Все имена и личная информация об участниках оставались конфиденциальными, а набор данных сохранялся анонимным для анализа.
Описание переменных
Статус ЖДА у детей был основной переменной исхода и определялся как наличие комбинации уровней гемоглобина <110 г / л и уровней ферритина <12 мкг / л [26]. Выбор объясняющих переменных для анализа был основан на литературе и их наличии в наборе данных и полностью описан в Таблице 1. Переменные были сгруппированы в три категории; домашние, материнские и детские. В рамках категории домохозяйства район проживания, который был разделен на сельский и городской, социально-экономический статус, который был установлен путем расчета квинтилей благосостояния (от бедных до самых богатых) с использованием стандартного инструмента демографического обследования и обследования состояния здоровья и статуса продовольственной безопасности с использованием стандартного показателя отсутствия продовольственной безопасности домохозяйства Была рассмотрена шкала доступа, разработанная проектом технической помощи в области пищевых продуктов и питания (FANTA) [27] и отнесенная к категории (Продовольственная безопасность и отсутствие продовольственной безопасности).В материнской категории материнское образование определялось как количество завершенных лет образования (неграмотность / количество лет образования), материнская IDA оценивалась на основе низких концентраций гемоглобина (<120 г / л) и низких концентраций ферритина (<12 мкг / л) и ИМТ матери, рассчитанный на основе роста и веса матери и классифицированный как недостаточный вес <18,5, нормальный вес 18,5–24,99, избыточный вес / ожирение 25–34,99 и тяжелое ожирение ≥35, были исследованы. У ребенка переменные: пол, возраст, клиническая анемия, оцененная при физикальном осмотре конъюнктивы, дефицит витамина А, определяемый как концентрация витамина А в сыворотке <= 0.70 мкмоль / л и классифицируется как дефицитный и недефицитный, дефицит цинка определяется как концентрация цинка в сыворотке <60 мкг / дл и классифицируется как дефицитный и недефицитный, задержка роста определяется как z-показатель роста / длины тела к возрасту < -2, истощение, определяемое как z-оценка веса для роста <-2, недостаточная масса тела, определяемая как вес для z-показателя возраста <-2, согласно и история заражения червями, установленная посредством воспоминаний о заражении червями за последние шесть месяцев.
Статистический анализ:
Все анализы данных проводились в IBM SPSS версии 19 [28] с использованием сложной процедуры выборки, позволяющей внести корректировки в схему выборки, реализованную в исследовании.Частоты, наряду с взвешенными процентами, были представлены для выбранных предикторов, а для результатов были рассчитаны средние значения с 95% доверительными интервалами (ДИ). Анализ начался с простого одномерного анализа, за которым следовала многомерная логистическая регрессия. Не скорректированное отношение шансов с их 95% доверительным интервалом были представлены для двумерного анализа. Переменные, значимые при p <0,25, рассматривались для включения в многомерную модель. Ковариаты, которые были незначимыми на многомерном уровне, были последовательно исключены из модели после тщательной оценки искажения.Окончательная модель была выбрана на основе теоретической и статистической значимости предикторов. Частота ошибок 1-го типа была установлена на уровне 0,05. Оценки модели представлены с скорректированными отношениями шансов и 95% доверительным интервалом.
Результаты
Всего в анализ были включены 7138 детей в возрасте от 6 до 59 месяцев, из них 2373 (33,2%) детей имели ЖДА на основании низкого уровня гемоглобина и ферритина. Анализ образцов крови детей показал, что в целом (4264) 62,3% страдали анемией (концентрация гемоглобина <110 г / л), из тех, кто страдает анемией (283) 4.1% имели анемию тяжелой степени (<70 г / л) и (3981) 58,3% имели анемию средней степени (70 г / л - 109 г / л). Дефицит ферритина выявлен у (3361) 47,1% детей. Среди тех, у кого была ЖДА, средние значения концентраций гемоглобина и ферритина составляли 70 г / л и 6 мкг / л соответственно. Распространенность дефицита витамина А и цинка составляла 52,6% и 38,8% соответственно. Клиническая анемия обнаружена у 30,1% детей. Антропометрические данные определили, что 44,5% детей страдают задержкой роста, 15,5% - истощенными и 33.6% как недостаточный вес.
Среди материнских факторов распространенность ЖДА составила 20,0%, что было определено с использованием уровней материнского гемоглобина и ферритина, и согласно антропометрическим данным матери 16,0% матерей были классифицированы с недостаточным весом, 21,2% с избыточным весом и 11,1% с ожирением. Среди всех детей, включенных в анализ, большинство детей приехали из сельской местности (70,1%), 48,3% детей были девочки и 47,9% были в возрасте до 24 месяцев. На долю двух квинтилей с самым низким уровнем благосостояния приходилось 43 человека.3% исследуемой популяции, и два самых высоких показателя составили 36,0%. Из опрошенных домохозяйств 64,3% не имели продовольственной безопасности. Только 8,3% матерей сообщили, что их ребенок заражен глистами за последние шесть месяцев (Таблица 2).
Однофакторный анализ (таблица 3) показал, что ЖДА у детей в возрасте до пяти лет в Пакистане была значимо связана с возрастом менее 24 месяцев (OR 1,45 1,29–1,62 p <0,05), задержкой роста (OR 1,44 1,27–1,64). p <0,05) с недостаточным весом (OR 1,28 1,15–1,43 p <0.05), наличие клинической анемии (OR 5,03 4,41–5,74 p <0,05), заражение глистами в анамнезе (OR 1,33 1,10–1,62 p <0,05), наличие у матери ЖДА (OR 1,91 1,65–2,21 p <0,05) и домохозяйство отсутствие продовольственной безопасности (OR 1,23 1,08–1,41 p <0,05).
В многофакторной регрессии (таблица 3) только недостаточный вес больше не был значимо повышенным риском с детским IDA, а для переменных, которые остались, скорректированные отношения шансов были немного ослаблены: возраст <24 месяцев (AOR 1,40, 95% CI 1.18–1,55 p <0,05), задержка роста (AOR 1,42 CI 1,23–1,63 p <0,05), наличие матери с ЖДА (AOR 1,72 CI 1,47–2,01 p <0,05) и отсутствие продовольственной безопасности домохозяйства (AOR 1,20 CI 1,10–1,40 P < 0,05), за исключением наличия клинической анемии, для которой скорректированный OR увеличился (AOR 5,69 CI 4,93–6,56 p <0,05). Напротив, проживание в сельской местности (AOR 0,77 CI 0,65–0,90 p <0,05) и принадлежность к женскому полу (AOR 0,87 CI 0,76–0,98 p <0,05) были связаны с уменьшением вероятности ЖДА (Таблица 3).
Обсуждение
В нашем исследовании распространенность ЖДА у детей в возрасте 6–59 месяцев составила 33 человека.2%, что согласно критериям ВОЗ представляет собой «умеренное бремя» [2]. Мы также обнаружили значительную распространенность низкого уровня гемоглобина, дефицита витамина А, дефицита цинка, задержки роста, истощения, недостаточного веса и отсутствия продовольственной безопасности среди детей в возрасте 6–59 месяцев, проживающих в Пакистане.
Распространенность ЖДА в нашем исследовании ниже, чем в предыдущих исследованиях в других странах с низким уровнем ресурсов, таких как Палестина и Кения [29–30], и значительно ниже оценки из предыдущего исследования в Пакистане [14].Эти различия могут быть связаны с различиями в условиях исследования или такими факторами, как частота паразитарных инфекций и диетические привычки. В ранее опубликованном исследовании, проведенном в Пакистане, сообщалось, что распространенность ЖДА составляет 63% из меньшей выборки (n = 320), взятой из пригородной зоны, что несопоставимо с этим обследованием населения. Кроме того, это было проведено 18 лет назад, до введения железных фортификаций в Пакистане [31]. Наши результаты согласуются с данными о распространенности ЖДА в Казахстане (32.4%) [32], Йемен (34,2%) [33] и Национальное обследование питания Пакистана (36%), проведенное в 2001 г. [13], но выше, чем в исследованиях, проведенных в Марокко (20,4%) [34], Индии (23,1%). %) [35] и Иран (29,1%) [36].
Наше исследование показало, что отсутствие продовольственной безопасности в домохозяйствах в значительной степени связано с ЖДА у детей, что согласуется с имеющейся литературой, исследующей эту связь [37, 38 и 39]. Отсутствие продовольственной безопасности характеризуется либо отсутствием продовольствия, либо невозможностью его закупить и получить доступ к нему и имеет последствия в виде дефицита как макро-, так и микронутриентов.В Пакистане широко распространенная ситуация отсутствия продовольственной безопасности отражает экономическую нестабильность во многих районах страны [40]. Исследование обнаружило связь между железодефицитной анемией у матери и ЖДА у детей, что подтверждает предыдущие отчеты [18, 41–43] и подчеркивает, что ЖДА распространена у беременных и небеременных женщин репродуктивного возраста в Пакистане [13]. В нашем исследовании клиническое обследование детей выявило клиническую анемию в 53,6% случаев ЖДА. Таким образом, этот знак может помочь в диагностике там, где нет оборудования для биохимических исследований.
Мы обнаружили, что распространенность ЖДА в значительной степени связана с возрастом детей, при этом самые маленькие дети имеют самые высокие шансы на ЖДА. Этот вывод согласуется с аналогичными исследованиями, проведенными в Иране, Индии и на Филиппинах [36, 39, 44]. Первые два года жизни — это период быстрого роста с повышенной потребностью в железе, поэтому в этом возрасте увеличивается риск ЖДА. Более того, такие факторы, как ограниченный доступ к пище, богатой железом, неадекватные методы кормления детей грудного и раннего возраста, включая отсутствие исключительно грудного вскармливания, длительное грудное вскармливание и несоответствующее питание при отлучении от груди, а также рецидивирующие заболевания увеличивают вероятность развития ЖДА у маленьких детей [17, 39 и 45 ].Мы также обнаружили, что вероятность ЖДА увеличивается, когда у ребенка наблюдается задержка роста и отсутствие продовольственной безопасности, что позволяет предположить, что недоедание является фактором, способствующим ЖДА [9, 13, 46].
После поправки на другие факторы наше исследование показало, что у девочек и детей, проживающих в сельской местности, вероятность развития ЖДА была ниже. Существуют противоречивые данные о связи между полом и ЖДА у детей. В отличие от нашего исследования, данные из Йемена и Индии показали более высокую распространенность ЖДА у девочек, чем у мальчиков [36, 47]; однако исследования, проведенные в Западной Кении и Гаити, показали, что мальчики подвергаются большему риску [48, 49].В наших условиях дети, живущие в сельской местности, имеют больший доступ к зеленым листовым овощам, что может объяснить их снижение риска ЖДА.
Основная сила этого исследования — национально репрезентативная выборка с использованием надежных методов обнаружения железа и поправки на смешивающие факторы. Однако это исследование также имеет некоторые ограничения. Поперечный характер исследования означает, что временная взаимосвязь между ЖДА и соответствующими факторами не может быть установлена. Информация по различным показателям была собрана с использованием структурированного вопросника, который мог быть склонен к систематической ошибке вспоминания, а наличие некоторых недостающих данных также является потенциальным ограничением.Более того, мы не измеряли уровни витамина B12 и фолиевой кислоты в сыворотке, поэтому не можем измерить другие формы анемии, что предполагает некоторую ошибку классификации.
Представленные данные дают ценную информацию о распространенности ЖДА у детей, которая оставалась довольно постоянной в Пакистане на протяжении последнего десятилетия. Принимая во внимание бремя ЖДА у пакистанских детей, важно, чтобы такие вмешательства, как добавление железа, обогащение пищевых продуктов и диверсификация диеты, применялись в широком масштабе [50], в настоящее время добавки железа и обогащение пшеничной муки являются успешными стратегиями, применяемыми во всем мире.Имеются убедительные доказательства того, что добавление железа улучшает уровень гемоглобина и снижает распространенность ЖДА у детей [51–53]. Исследования, проведенные в Пакистане, также показывают, что добавление железа детям и матерям приводит к увеличению запасов железа [54–56]. Кроме того, недавний объединенный анализ и исследования в Центральной Азии, Венесуэле и Иране показывают, что обогащение пшеничной муки может значительно улучшить статус железа на уровне населения [54, 57–60], но в Пакистане отсутствуют такие программы по добавлению добавок.
Чтобы уменьшить бремя МАР, Пакистану необходим целостный подход к краткосрочным вертикальным программам, таким как добавление железа, и долгосрочным горизонтальным программам, включая обогащение пшеничной муки. В частности, следует предпринять дальнейшие усилия по восстановлению национальной программы обогащения пшеничной муки, поскольку пшеница является основным продуктом питания Пакистана. Для улучшения также требуются дополнительные вложения; образование, особенно для женщин, отсутствие продовольственной безопасности за счет пищевых добавок и поддержки сельского хозяйства.Для этого могут потребоваться новые методы, такие как обмен информацией об изменении поведения для улучшения моделей питания и практики прикорма детей грудного и раннего возраста (КДВК). Наконец, для того, чтобы это поколение пакистанских детей принесло пользу, важно, чтобы Пакистан быстро принял меры по снижению распространенности ЖДА.
Благодарности
Эта рукопись является частью диссертации MAH, которая соответствует требованиям для получения докторской степени в Сиднейском университете. Мы благодарны Отделу здоровья женщин и детей Университета Ага Хана за предоставление данных Национального исследования питания за 2011–2012 годы для вторичного анализа.Мы также благодарны Сиднейскому университету за финансирование стипендии доктора философии MAH (IPRS / APA) и финансирование CRG через стипендию NHMRC для развития карьеры. Мы хотели бы поблагодарить всех участников, принявших участие в исследовании, интервьюеров, лаборантов, редакторов данных и операторов данных.
Вклад авторов
Задумал и спроектировал эксперименты: ZAB SBS MAH KB CRG. Проведены эксперименты: MAH SBS IH. Проанализированы данные: ZB MAH. Предоставленные реагенты / материалы / инструменты анализа: ZAB ZB SBS MAH KB CRG.Написал статью: MAH KB CRG SBS ZAB.
Ссылки
- 1.
Маклин Э., Когсуэлл М., Эгли И., Войдила Д., Де Бенуа Б. Распространенность анемии во всем мире, Информационная система ВОЗ по витаминам и минералам, 1993–2005 гг. Общественное здравоохранение. 2009 1 апреля; 12 (04): 444–54. - 2.
ВОЗ UNCF, UNU (2001) Оценка, профилактика и контроль железодефицитной анемии: руководство для руководителей программ. Женева. - 3.
Бадхэм Дж., Циммерманн М.Б., Кремер К., редакторы.Справочник диетической анемии. Базель, Швейцария: Sight and Life Press; 2007. - 4.
ВОЗ. Дефицит микронутриентов — железодефицитная анемия. ВОЗ; Доступно: http://www.who.int/nutrition/topics/ida/en/. По состоянию на 28 сентября 2015 г. - 5.
Grantham-McGregor S, Ani C. Обзор исследований влияния дефицита железа на когнитивное развитие у детей. Журнал питания. 2001, 1 февраля; 131 (2): 649S – 68S. - 6.
Лозофф Б, Георгиев МК.Дефицит железа и развитие мозга. В «Семинарах по детской неврологии», 30 сентября 2006 г. (Том 13, № 3, стр. 158–165). У. Б. Сондерс. - 7.
Блэк ММ, Куигг А.М., Херли К.М., Пеппер МР. Железодефицитная и железодефицитная анемия в первые два года жизни: стратегии предотвращения потери потенциала развития. Обзоры питания. 1 ноября 2011 г .; 69 (приложение 1): S64–70. pmid: 22043885 - 8.
Скотт SP, Чен-Эдинборо LP, Колфилд LE, Мюррей-Колб LE. Влияние анемии на детскую смертность: обновленный обзор.Питательные вещества. 2014 22 декабря; 6 (12): 5915–32. pmid: 25533005 - 9.
Stoltzfus RJ. Определение железодефицитной анемии с точки зрения общественного здравоохранения: время для размышлений. Журнал питания. 2001, 1 февраля; 131 (2): 565S – 7S. - 10.
Институт показателей и оценки здоровья. Глобальное бремя болезней: создание доказательств, руководящая политика. Сиэтл, Вашингтон: IHME, 2013 - 11.
Балараджан Й., Рамакришнан У., Озалтин Э., Шанкар А.Х., Субраманиан С.В. Анемия в странах с низким и средним доходом.Ланцет. 2012 г., 6 января; 378 (9809): 2123–35. - 12.
Хамедани П., Хашми К.З., Манджи М. Истощение запасов железа и анемия: распространенность, последствия, диагностические и терапевтические последствия для развивающегося населения Пакистана. Текущие медицинские исследования и мнения. 1987, 1 января; 10 (7): 480–5. pmid: 3621993 - 13.
Пакистанский институт экономики развития, Лаборатории микронутриентов Университета Ага Хана и Медицинский центр Карачи. Национальное обследование питания 2001–2002 гг. Исламабад, Пакистан: Комиссия по планированию, Правительство Пакистана и ЮНИСЕФ, 2004 г. - 14.
Парача П.И., Хамид А., Саймон Дж., Джамил А., Наваб Г. Распространенность анемии в пригородных районах Пешавара, Пакистан — проблема для медицинских работников и политиков. Журнал Пакистанской медицинской ассоциации. 1997 февраль; 47: 49–53. - 15.
Молла А., Хуршид М., Молла А.М. Распространенность железодефицитной анемии у детей городских трущоб Карачи. Распространенность. 1992. - 16.
Рахбар М.Х., Хожабри С., Ван Дж. Распространенность анемии среди детей, живущих в пяти общинах в Карачи и его окрестностях, Пакистан.Токсикологическая и экологическая химия. 2007 г., 1 апреля; 89 (2): 337–46. - 17.
Ахтар С., Ахмед А., Ахмад А., Али З., Риаз М., Исмаил Т. Железный статус пакистанского населения — текущие проблемы и стратегии. Азиатско-Тихоокеанский журнал клинического питания. 2013; 22 (3): 340. pmid: 23945403 - 18.
Ахмед А., Ахмад А., Халид Н., Дэвид А., Сандху М.А., Рандхава М.А. и др. Вопросительный знак о дефиците железа у 185 миллионов человек в Пакистане: его исходы и профилактика. Критические обзоры в области пищевой науки и питания.2014, 2 декабря; 54 (12): 1617–35. pmid: 24580562 - 19.
Национальный институт демографических исследований (NIPS) [Пакистан] и ICF International. Обзор демографии и здравоохранения Пакистана, 2012–2013 гг. Демографические и медицинские исследования. Исламабад, Пакистан, и Калвертон, Мэриленд, США: NIPS и ICF International, 2013 - 20.
Всемирная продовольственная программа, Пособие: измерение и интерпретация недоедания и смертности. 2005. Доступно: http://www.unhcr.org/45f6abc92.pdf - 21.ВОЗ (2009) Anthro Plus для руководства по персональным компьютерам: Программное обеспечение для оценки роста детей и подростков во всем мире. Доступно: http://www.who.int/growthref/tools/en. По состоянию на сентябрь 2015 г.
- 22.
Guyatt GH, Oxman AD, Ali M, Willan A, McIlroy W, Patterson C. Лабораторная диагностика железодефицитной анемии. Журнал общей внутренней медицины. 1992 1 марта; 7 (2): 145–53. pmid: 1487761 - 23.
Турнем Д.И., МакКейб Л.Д., Халдар С., Виринга Ф.Т., Нортроп-Клюз, Калифорния, МакКейб Г.П.Регулировка концентраций ферритина в плазме для устранения эффектов субклинического воспаления при оценке дефицита железа: метаанализ. Американский журнал лечебного питания. 1 сентября 2010 г .: ajcn-29284. - 24.
Грант Ф.К., Сучдев П.С., Флорес-Айяла Р., Коул С.Р., Рамакришнан У., Рут Л.Дж. и др. Коррекция воспаления изменяет оценки дефицита железа у сельских детей дошкольного возраста в Кении. Журнал питания. 2012, 1 января; 142 (1): 105–11. pmid: 22157541 - 25.ВОЗ. Концентрация гемоглобина для диагностики анемии и оценки степени тяжести. Информационная система о витаминном и минеральном питании. Женева, Всемирная организация здравоохранения, 2011 г. (WHO / NMH / NHD / MNM / 11.1). Доступно: http://www.who.int/vmnis/indicators/haemoglobin.pdf
- 26.
Пасрича С.Р., Флекно-Браун С.К., Аллен К.Дж., Гибсон П.Р., МакМахон Л.П., Олиник Дж.К. и др. Диагностика и лечение железодефицитной анемии: обновленная клиническая информация. Med J Aust. 2010, 1 ноября; 193 (9): 525–32.pmid: 21034387 - 27.
Коутс Дж., Суиндейл А., Билински П. Шкала доступа к продовольственной безопасности домашних хозяйств (HFIAS) для измерения доступа к продовольствию: руководство по показателям. Вашингтон, округ Колумбия: Проект технической помощи в области пищевых продуктов и питания, Академия развития образования. 2007 Август - 28.
IBM Corp. Выпущена в 2010 году. IBM SPSS Statistics для Windows, версия 19.0. Армонк, Нью-Йорк: IBM Corp. - 29.
Сирдах М.М., Яги А., Яги А.Р. Железодефицитная анемия среди детей детских садов, проживающих в маргинализованных районах сектора Газа, Палестина.Revista brasileira de hematologia e hemoterapia. 2014 Апрель; 36 (2): 132–8. pmid: 247 - 30.
Onimawo IA, Ukegbu PO, Asumugha VU, Anyika JU, Okudu H, Echendu CA и др. Оценка анемии и статуса железа у детей школьного возраста (в возрасте 7–12 лет) в сельских общинах штата Абиа, Нигерия. Африканский журнал продовольствия, сельского хозяйства, питания и развития. 2010; 10 (5). - 31.
Правительство Пакистана, отчет о мерах по питанию в Пакистане. В наличии: http: // pc.gov.pk/mtdf/8-Nutrition/8-Nutrition.pdf - 32.
Хашизуме М., Куни О, Сасаки С., Шимода Т., Вакаи С., Мажитова З. и др. Анемия и дефицит железа у школьников Приаралья, Казахстан. Журнал тропической педиатрии. 1 июня 2003 г., 49 (3): 172–7. pmid: 12848209 - 33.
Аль-Забеди Е.М., Кайд Ф.А., Сади Х., Аль-Адрой А.Х., Амран А.А., Аль-Мактари М.Т. Распространенность и факторы риска железодефицитной анемии среди детей в Йемене. Американский журнал исследований в области здравоохранения.2014. 2 (5): 319–26. - 34.
Эль-Хиуи M13, Ahami AO, Aboussaleh Y. Дефицит железа и анемия у сельских школьников в прибрежной зоне Марокко. Пакистанский журнал питания. 2008. 7 (3): 400–3. - 35.
Джйотсна К., Мадхави С., Нагавени Д., Нараян Д., Мека Р. Анемия, дефицит железа, потребление мяса и анкилостомоз у женщин репродуктивного возраста в сельской местности в Андхра-Прадеш. Ann Biol Res. 2011. 2 (3): 209–16. - 36.
Кейхаи Б., Зандиан К., Гасеми А., Табиби Р.Железодефицитная анемия у детей на юго-западе Ирана. Бюллетень по продуктам питания и питанию. 15 декабря 2007 г.; 28 (4): 406–11. pmid: 18274167 - 37.
Скалики А., Мейерс А.Ф., Адамс В.Г., Ян З., Кук Дж.Т., Фрэнк Д.А. Отсутствие продовольственной безопасности у детей и железодефицитная анемия у младенцев и детей ясельного возраста с низким доходом в Соединенных Штатах. Журнал здоровья матери и ребенка. 1 марта 2006 г.; 10 (2): 177–85. pmid: 16328705 - 38.
Парк К., Керси М., Гепперт Дж., Стори М., Каттс Д., Хаймс Дж. Х. Отсутствие продовольственной безопасности в домохозяйстве является фактором риска железодефицитной анемии в многоэтнической выборке детей грудного и раннего возраста с низким доходом.Общественное здравоохранение. 2009 1 ноября; 12 (11): 2120–8. pmid: 19405987 - 39.
Пасрича С.Р., Блэк Дж., Мутайя С., Шет А., Бхат В., Нагарадж С. и др. Детерминанты анемии среди детей раннего возраста в сельских районах Индии. Педиатрия. 1 июля 2010 г .; 126 (1): e140–9. pmid: 20547647 - 40.
Кугельман М., редактор. Голодные боли: отсутствие продовольственной безопасности Пакистана. Международный центр ученых Вудро Вильсона; 2010. - 41.
Кумар А., Рай А. К., Басу С., Даш Д., Сингх Дж. С. Статус железа в пуповинной крови и грудном молоке при материнской анемии.Педиатрия. 1 марта 2008 г .; 121 (3): e673–7. pmid: 18310187 - 42.
Singla PN, Tyagi M, Shankar R, Dash D, Kumar A. Состояние железа плода при материнской анемии. Acta Paediatrica. 1996 г., 1 ноября; 85 (11): 1327–30. pmid: 8955460 - 43.
Sweet DG, Savage G, Tubman TR, Lappin TR, Halliday HL. Изучение влияния матери на уровень железа у плода в срок с использованием рецепторов трансферрина пуповинной крови. Архивы болезней детского возраста и новорожденных. 2001, 1 января; 84 (1): F40–3. pmid: 11124923 - 44.Tengco LW, Rayco-Solon P, Solon JA, Sarol JN Jr, Solon FS. Детерминанты анемии среди детей дошкольного возраста на Филиппинах. Журнал Американского колледжа питания. 2008 г., 1 апреля; 27 (2): 229–43. pmid: 18689554
- 45.
Чарльз CV. Железодефицитная анемия: проблема общественного здравоохранения глобального масштаба. Общественное здравоохранение — методология, экологические и системные вопросы. 2012: 109. - 46.
Desalegn A, Mossie A, Gedefaw L. Пищевая железодефицитная анемия: масштабы и ее предикторы среди детей школьного возраста, юго-запад Эфиопии: перекрестное исследование на уровне общины.ПлоС один. 2014 1 декабря; 9 (12): e114059. pmid: 25438147 - 47.
Каур И.П., Каур С. Сравнение профиля питания и распространенности анемии среди сельских девочек и мальчиков. Журнал науки о физических упражнениях и физиотерапии. 2011 июн; 7 (1): 11. - 48.
Фут Е.М., Салливан К.М., Рут Л.Дж., Оремо Дж., Садума И., Уильямс Т.Н. и др. Детерминанты анемии среди детей дошкольного возраста в сельских районах западной Кении. Американский журнал тропической медицины и гигиены. 2013 г. 3 апреля; 88 (4): 757–64.pmid: 23382166 - 49.
Бернард С. Распространенность и факторы риска анемии среди детей в возрасте 6–59 месяцев на Гаити. Анемия. 2013 10 марта; 2013. - 50.
Pasricha SR, Drakesmith H, Black J, Hipgrave D, Biggs BA. Контроль железодефицитной анемии в странах с низким и средним уровнем доходов. Кровь. 2013 г. 4 апреля; 121 (14): 2607–17. pmid: 23355536 - 51.
Гера Т., Сачдев Х.П., Нестель П., Сачдев С.С. Влияние добавок железа на ответ гемоглобина у детей: систематический обзор рандомизированных контролируемых исследований.Журнал детской гастроэнтерологии и питания. 2007 г., 1 апреля; 44 (4): 468–86. pmid: 17414146 - 52.
Сильвецкий А.С., Джеффердс М.Э., Де-Регил Л.М., Доусвелл Т. Периодическое введение добавок железа для улучшения питания и результатов развития у детей. Кокрановская библиотека. 2011. - 53.
Pasricha SR, Hayes E, Kalumba K, Biggs BA. Влияние ежедневного приема добавок железа на здоровье детей в возрасте 4–23 месяцев: систематический обзор и метаанализ рандомизированных контролируемых исследований.The Lancet Global Health. 31 августа 2013 г .; 1 (2): e77–86. pmid: 25104162 - 54.
Софи С., Кузенс С., Икбал С.П., Ахунд Т., Хан Дж., Ахмед И. и др. Влияние ежедневного приема цинка и железа с несколькими питательными микроэлементами на рост и заболеваемость детей младшего возраста в Пакистане: кластерное рандомизированное исследование. Ланцет. 12 июля 2013 г .; 382 (9886): 29–40. - 55.
Нисар Ю.Б., Дибли MJ. Антенатальный прием препаратов железа и фолиевой кислоты снижает риск низкой массы тела при рождении в Пакистане: вторичный анализ демографического и медицинского обследования 2006–2007 гг.Материнское и детское питание. 2016, 1 января; 12 (1): 85–98. - 56.
Бхутта З.А., Ризви А., Раза Ф., Хотвани С., Заиди С., Хоссейн С.М. и др. Сравнительная оценка приема нескольких микронутриентов и добавок железа и фолиевой кислоты во время беременности в Пакистане: влияние на исходы беременности. Бюллетень по продуктам питания и питанию. 2009 25 декабря; 30 (4 доп. 4): S496–505. pmid: 20120791 - 57.
Дас Дж. К., Салам Р. А., Кумар Р., Бхутта З.А. Обогащение пищевых продуктов микронутриентами и его влияние на здоровье женщин и детей: систематический обзор.Систематические обзоры. 2013 23 августа; 2 (1): 1. - 58.
Тажибаев С., Долматова О., Ганиева Г., Хаиров К., Оспанова Ф., Оюнчимег Д. и др. Оценка потенциальной эффективности программ обогащения пшеничной муки и соли в пяти странах Центральной Азии и Монголии, 2002–2007 гг. Бюллетень по продуктам питания и питанию. 15 декабря 2008 г .; 29 (4): 255–65. pmid: 150 - 59.
Layrisse M, García-Casal MN, Méndez-Castellano H, Jiménez M, Olavarría HC, Chávez JF, et al. Влияние обогащения муки железом на снижение распространенности анемии и дефицита железа среди школьников в Каракасе, Венесуэла: наблюдение.Бюллетень по продуктам питания и питанию. 2002 декабрь 1; 23 (4): 384–9. pmid: 16619746- 60.
Садиги Дж., Мохаммад К., Шейхолеслам Р., Амирхани М.А., Тораби П., Салехи Ф. и др. Контроль анемии: уроки программы обогащения муки. Здравоохранение. 31 декабря 2009 г .; 123 (12): 794–9. pmid: 191 .
- 59.