Содержание
Внутриутробное развитие плода
Практически каждой будущей маме в такое особенное для нее время, как беременность, хочется знать: что же происходит с ее организмом? Как крохотный эмбрион становится малышом с глазками, ручками и ножками, готовый появиться на свет? Как проходит этот невероятный и интересный процесс, называемый внутриутробным развитием?
Внутриутробное развитие – важнейшая часть жизни человека. Во время этого процесса происходит развитие и формирование организма, которое, как правило, длится 9 месяцев с момента зачатия и до кульминационного момента – рождения.
В случае появления малыша на свет раньше положенного срока, его помещают в специальный бокс, где ребенок в поддерживаемых условиях формируется и догоняет других малышей в развитии. В наше время, когда медицина всё более развита, врачи способны выходить детей, появившихся на свет и на седьмом, и на восьмом месяце беременности.
Процесс внутриутробного развития можно разделить на триместры, каждый из которых имеет свои особенности:
Первый триместр, длится от зачатия до тринадцатой недели.

Триместр, во время которого происходит настоящее волшебство: из скопления клеток появляется почти уже человек, у которого в зачаточном состоянии сформировано большинство органов – мозг, маленькое сердечко, нервная система и даже зачатки мышечной системы.
А у мамы в это же время начинаются первые изменения в организме, иногда не самые приятные. Большинство женщин считают именно первый триместр самым сложным из-за токсикоза, смены гормонального фона и общего стресса.
Второй триместр, длится с тринадцатой до двадцать седьмой недели.
Ранее появившийся органы и системы продолжают своё развитие. Ребенок уже начинает слышать звуки благодаря развитию органов чувств, начинают свою работу мочевыделительная система и кишечник, а кроветворная система производит красные и белые кровяные тельца.
И пока малыш потихоньку начинает познавать окружающий его мир, у мамы продолжаются изменения в организме. Токсикоз, появившийся в первом триместре, постепенно уходит, но могут появиться другие симптомы. В этот период женщине показано «есть за двоих» и не забывать о необходимых витаминах, минералах и питательных веществах.
В этот период женщине показано «есть за двоих» и не забывать о необходимых витаминах, минералах и питательных веществах.
Третий триместр, длится с двадцать восьмой недели до рождения.
Малыш уже готов появиться на свет – он активно набирает вес, начинает видеть, чувствовать вкус, у ребенка заметны первые рефлексы, например, сосательный, его легкие уже полностью сформированы.
Мама уже заждалась своего малыша – последние недели самые тяжелые в том числе из-за нетерпения. Становится всё сложнее носить большой живот – ребенок уже стал достаточно тяжелым, что отзывается и болями в спине, и давлением на мочевой пузырь с легкими.
Эти три триместра – одни из важнейших периодов в жизни каждой мамы. Главное не забывать следить за собственным здоровьем, грамотно питаться, давать малышу все необходимые витамины и минералы, а также следовать советам для каждого триместра, и эти девять месяцев ожидания наградят вас здоровым крохой.
Диагностика врожденных пороков развития плода.
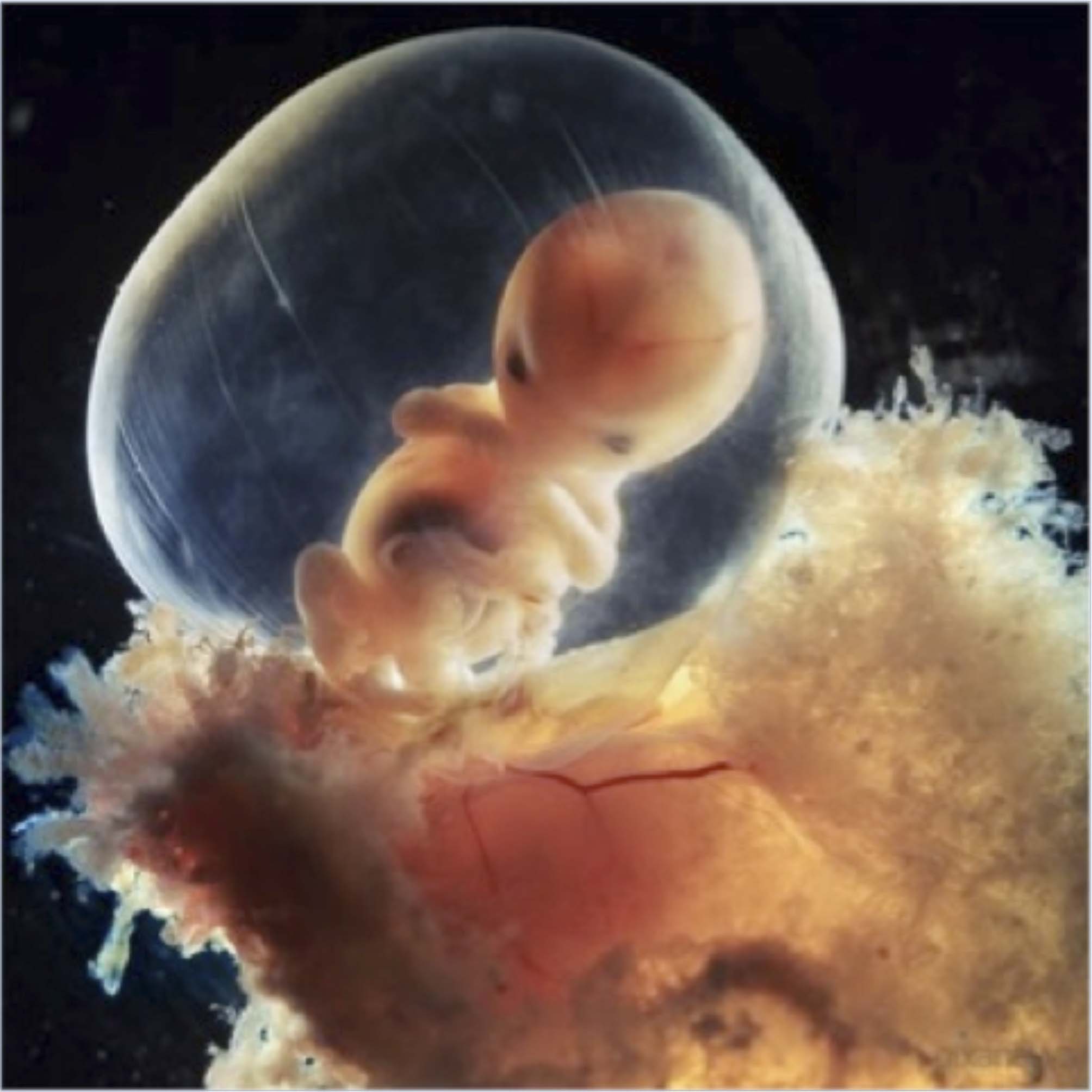
Диагностика врожденных пороков развития плода входит в перечень обязательных исследований, проводимых женщине во время беременности. И это неслучайно, ведь внутриутробные пороки развития плода — одна из основных причин перинатальной смертности и инвалидности детей.
Причин пороков внутриутробного развития ребенка может быть много. Патология иногда имеет наследственный характер, ее причинами могут стать негативные внешние и внутренние факторы. Итог один — страшный удар для всей семьи, который далеко не всем удается выдержать с достоинством, и это при том, что сегодня в России 5 детей из 100 рождаются с подобными проблемами.
Какие пороки внутриутробного развития плода могут быть выявлены уже во время беременности?
- Синдром Дауна или трисомия по 21-й паре хромосом, что в дальнейшем приводит к множественным порокам развития внутренних органов и умственной отсталости.
- Синдром Эдвардса или трисомия по 18-й паре хромосом, характеризующийся пороками формирования многих внутренних органов.

- Пороки развития нервной трубки, проявляющиеся отсутствием головного мозга (анэнцефалией) дефектами заращения спинномозгового канала и формированием грыжи спинного мозга (spina bifida).
- Пороки развития сердца и легких.
- Пороки развития конечностей.
- Пороки развития лицевой части черепа, например, волчья пасть, заячья губа и т.д.
Дородовая диагностика пороков внутриутробного развития ребенка проводится в два основных этапа, включающих УЗИ и анализы крови.
Впервые женщина должна посетить кабинет УЗИ при 10-14 недельном сроке беременности, что позволяет подтвердить наличие беременности; узнать, маточная или внематочная беременность; определить срок беременности с точностью до 2-3 дней; выявить многоплодную беременность; исключить ложную беременность и выраженные анатомические отклонения. А самое главное – признаки хромосомных аномалий синдрома Дауна, которые позже могут и не проявить себя, определение которых в большей степени зависит от квалификации врача и уровня УЗИ аппаратуры.
Анализ крови:
- b-ХГЧ или свободную b-субъединицу хорионического гормона.
- ПАПП-А белок или ассоциированный с беременностью протеин плазмы.
Если выявлены отклонения в развитии плода, то при сроке 16-18 недель беременности проводится тройной биохимический тест, учитывающий результаты первого скрининга и включающий в себя:
- анализ крови на альфа-фетопротеин;
- анализ крови на свободный эстриол;
- анализ крови на b-ХГЧ.
Проведение ультразвукового исследования в сроке 20-24 недель позволяет выявить соответствие развития плода предполагаемому сроку беременности; диагностику пороков развития плода; даются рекомендации по продолжению беременности (или ее прерыванию при выявлении тяжелых аномалий развития плода). В этом сроке все органы полностью сформированы, можно оценить их строение и, косвенно, функцию. Детально исследуется каждый орган плода. При исследовании головки, оценивается форма и толщина костей черепа, структура мозга, его полушарий, подкорковых образований, мозжечка и желудочков мозга. Анализируется строение лицевого черепа и мягких тканей лица. Исключаются дефекты позвонков (грыжи и искривления, отсутствие позвонков). Оценивается форма и размеры грудной клетки, ребер, лопаток. Исследуют область передней брюшной стенки для исключения пупочной грыжи. Затем исследуют ручки и ножки будущего ребенка, оценивая движения в суставах, длину и толщину трубчатых костей. В этом сроке беременности особенно тщательно исследуется сердце плода. При этом диагностируется большинство серьезных пороков сердца,в том числе несовместимых с жизнью или требующих оперативного лечения в ранние сроки после рождения ребенка. Изучаются другие внутренние органы плода, которые уже практически сформированы и доступны для исследования. Это легкие, кишечник, селезенка, желудок, печень и желчный пузырь, почки и мочевой пузырь. Вновь исключаются хромосомные маркеры и риск по хромосомной патологии. Проводится ультразвуковое исследование плаценты, пуповины, околоплодных вод, оцениваются особенности тела, шейки матки и ее придатков.
Анализируется строение лицевого черепа и мягких тканей лица. Исключаются дефекты позвонков (грыжи и искривления, отсутствие позвонков). Оценивается форма и размеры грудной клетки, ребер, лопаток. Исследуют область передней брюшной стенки для исключения пупочной грыжи. Затем исследуют ручки и ножки будущего ребенка, оценивая движения в суставах, длину и толщину трубчатых костей. В этом сроке беременности особенно тщательно исследуется сердце плода. При этом диагностируется большинство серьезных пороков сердца,в том числе несовместимых с жизнью или требующих оперативного лечения в ранние сроки после рождения ребенка. Изучаются другие внутренние органы плода, которые уже практически сформированы и доступны для исследования. Это легкие, кишечник, селезенка, желудок, печень и желчный пузырь, почки и мочевой пузырь. Вновь исключаются хромосомные маркеры и риск по хромосомной патологии. Проводится ультразвуковое исследование плаценты, пуповины, околоплодных вод, оцениваются особенности тела, шейки матки и ее придатков.
При проведении ультразвукового исследования в сроке 30-34 недель можно выявить возможное наличие синдрома задержки развития плода; выявить возможные патологии плода, которые не были по тем или иным причинам выявлены на более ранних сроках беременности; определить количество околоплодных вод. Проводится измерение частей тела плода (головки, грудной клетки, конечностей) с целью оценки его роста, веса и пропорций. Эти измерения позволяют исключить задержку развития плода. К 28 неделе у плода округляются щёчки, лицо становится более сформированным, различимы губки, носик. Он может почесать ушко, сложить кулачки, зевнуть, состроить гримасу, улыбнуться.
В раннем сроке беременности измеряют кровоток в артериях матки, для выявления беременных с высоким риском гестоза второй половины беременности и задержке развития плода. Это исследование также помогает при ведении беременных, страдающих сахарным диабетом и сосудистыми нарушениями.
По результатам УЗИ, на всех сроках беременности, даются рекомендации по вендению беременности. При возникновении патологии, женщины обязательно консультируются с ведущими специалистами областного Перинатального центра, проводится диагностика хромосомного набора плода. При необходимости женщина направляется на городской, областной перинатальный консилиум для определения последующей тактики ведения беременной и будущем обследовании ребенка.
При возникновении патологии, женщины обязательно консультируются с ведущими специалистами областного Перинатального центра, проводится диагностика хромосомного набора плода. При необходимости женщина направляется на городской, областной перинатальный консилиум для определения последующей тактики ведения беременной и будущем обследовании ребенка.
Группа риска развития внутриутробных аномалий
Высокий риск внутриутробных аномалий имеют:
- возрастные пары, в которых возраст женщины превышает 35 лет;
- потенциальные родители, имеющие близких родственников с наследственными заболеваниями;
- пары, имевшие опыт рождения больных детей;
- супруги, подвергавшиеся радиоактивному облучению;
- женщины с привычным невынашиванием беременности;
- женщины с «плохими» результатами скрининга.
Помните! Чем раньше обнаружена патология, тем больше у врача шансов исправить «ошибку природы», вмешаться в ход беременности, основательно подготовить мать и ребенка к родам и последующему лечению.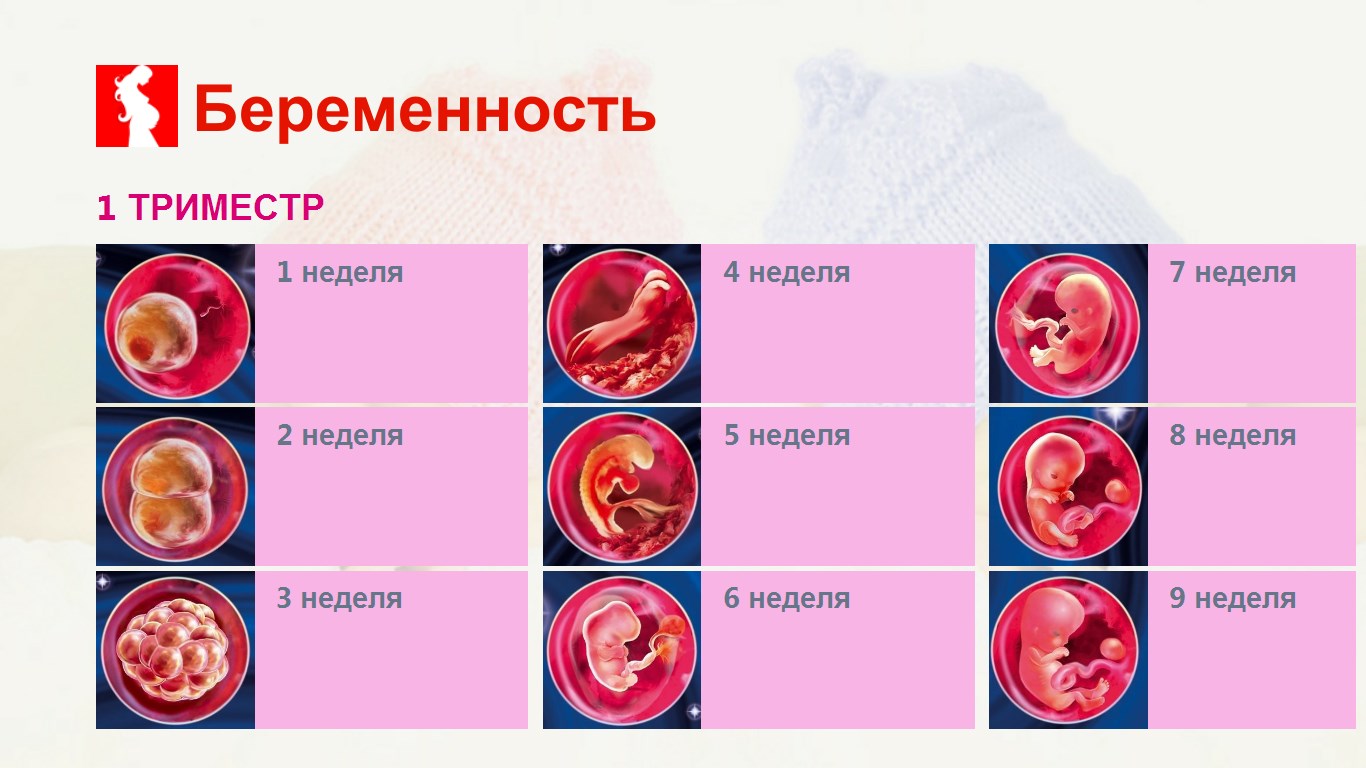
Главный врач медицинского центра «Тет-а-Тет», акушер-гинеколог, врач высшей категории Ульянова Сания Музагитовна.
КАК ИЗБЕЖАТЬ ВРОЖДЁННЫХ ПОРОКОВ РАЗВИТИЯ У СВОЕГО РЕБЁНКА?
До сих пор в Украине до 6% детей рождается с врожденными пороками развития (ВПР). Именно они являются основной причиной смертности и инвалидизации детей до 1 года. Во избежание многих аномалий развития плода достаточно перед планированием беременности обратиться к врачам, пройти ряд доступных обследований и правильно подготовиться к зачатию. К сожалению, большинство супружеских пар пренебрегают этими простыми правилами.
Именно для распространения информации о шагах, которые следует делать всем будущим родителям, чтобы иметь здоровых детей, в 2015 году был основан Всемирный день предупреждения врожденных пороков развития. Отмечают его ежегодно 3 марта.
Что конкретно нужно сделать?
1) Принимать фолиевую кислоту (витамин В9) до и во время беременности. Нехватка этого вещества в организме женщины на момент зачатия может вызвать такие серьезные недостатки в развитии плода, как анэнцефалия, дефекты невральной трубки, мозговые грыжи, гидроцефалию («водянка головного мозга»).
Нехватка этого вещества в организме женщины на момент зачатия может вызвать такие серьезные недостатки в развитии плода, как анэнцефалия, дефекты невральной трубки, мозговые грыжи, гидроцефалию («водянка головного мозга»).
Фолиевая кислота нужна не только женщинам, планирующим беременность, но и мужчинам. Фолат вместе с витаминами C, E и цинком участвуют в образовании здоровых сперматозоидов. Доказано, что фолиевую кислоту можно принимать с профилактической целью до зачатия ребенка. Поэтому баночка этого препарата будет лучшим подарком на свадьбу молодой паре, которая планирует рождение детей.
Всемирная организация здравоохранения рекомендует женщинам и мужчинам за 1-2 месяца до первых попыток зачать ребенка ежедневно употреблять по 400 микрограмм фолиевой кислоты.
2) Контролировать употребления алкоголя. А ещё лучше отказаться от него вообще за 2-3 месяца до планирования беременности. Ведь пренатальное влияние алкоголя является одной из самых частых причин нарушения умственного развития детей.
По статистике, более 3% беременных женщин употребляют алкоголь в значительных дозах, что может привести к отклонениям в умственном развитии ребенка. Уже доказана взаимосвязь между употреблением беременной алкоголя и частотой выявления пороков сердца у новорожденных.
Кроме того, алкоголь приводит к рождению детей с алкогольным синдромом плода (АСП). Обычно 41% таких детей попадают в интернаты. А 7% из них не доживают и до года.
3) Вакцинироваться, согласно Календаря иммунизации, желательно всем взрослым в семье, где планируют рождение ребенка. В частности, доказано, что перенесенная женщиной во время беременности краснуха приводит к аномалиям развития сердечно-сосудистой и нервной систем ребенка, врожденной патологии органов зрения и слуха.
4) Планировать беременность. Желание супружеской пары правильно зачать, выносить и родить здорового ребенка уже является залогом того, что беременность и роды пройдут успешно, а ребенок родится здоровым.
Поэтому парам, которые планируют пополнение, врач акушер-гинеколог и врач-генетик, руководитель женской консультации Медицинского центра «Медикавер» Марьяна Тенета, советует прийти к врачу за 4-6 месяцев до попыток зачатия ребенка и пройти обследование.
Перед началом обследований важно исследовать и рассказать друг другу (а также и врачам во время консультаций) обо всех болезнях, которые случались в семьях мужа и жены.
Обследование женщины начинается с визита к гинекологу, который проводит общий осмотр, ультразвуковое обследование органов малого таза и щитовидной железы, берет мазок на флору и цитологию, проверяет, нет ли хронических урогенитальных и TORCH-инфекций, направляет на анализы на ВИЧ и сифилис, гепатиты В и С. Полезно сделать также общеклинические анализы: крови (с определением группы и резуса), мочи, обследоваться на уровень тиреотропного гормона, который регулирует репродуктивную функцию. Если у женщины есть хронические заболевания или патологии, то желательно пройти дополнительный осмотр и у профильных специалистов.
Для мужчин перечень обследований короче, но не менее важный: анализ на ВИЧ и сифилис, урогенитальные инфекции, гепатиты В и С, спермограмма, которая показывает количество, качество и подвижность сперматозоидов.
Есть и другие факторы, вызывающие врожденные пороки развития у детей, но предотвратить их гораздо труднее, чем перечисленные выше. Это – радиация, неблагоприятная экологическая ситуация, действие различных химикатов и лекарственных средств. К сожалению, для Украины, до сих пор переживающей последствия Чернобыльской катастрофы, они являются чрезвычайно актуальными.
Стало быть, мы и так живём в зоне риска. Не испытывайте себя на прочность. Позаботьтесь о будущем – следите за здоровьем и планируйте беременность, чтобы появление детей было для вас настоящей радостью, а не очередным испытанием на прочность.
Опытные же врачи медицинских учреждений Медикавер в Украине помогут вам в этом.
Врожденные пороки развития плода | Малоритская Центральная Районная больница
Врожденные пороки развития (ВПР) стоят на третьем месте среди факторов, приводящих к смертности плода во время беременности, в родах и в послеродовом периоде.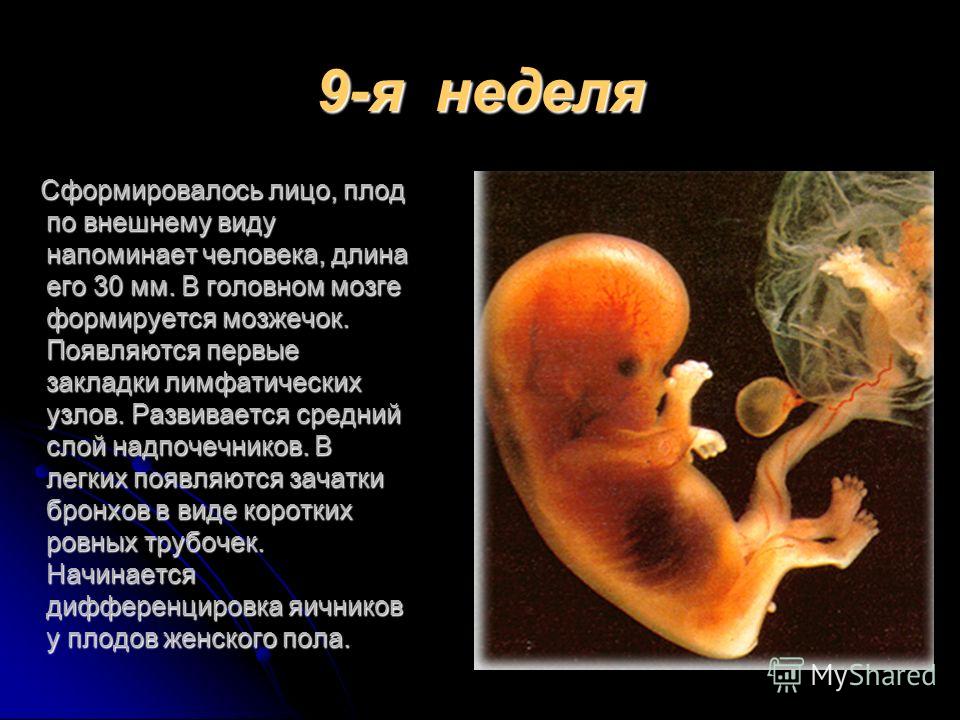
Осложнения, вызванные этими пороками, могут сказываться на здоровье человека на протяжении всей жизни. Различают пороки развития:
— легко-корригируемые;
— несовместимые с жизнью;
— совместимые с жизнью, но существенно осложняющие её.
ВПР возникают как следствие нарушений внутриутробного развития плода. ВПР являются наиболее серьезной угрозой нормального развития беременности, которая в большинстве случаев приводит к детской инвалидности и смертности. Среди врожденных пороков развития различают анэнцефалию (неразвитость головного мозга), пороки развития нервной системы, пороки сердца, спина Бифида (наружная грыжа спинного мозга), пороки конечностей или их отсутствие, челюстно-лицевые деформации, в частности волчья пасть, заячья губа и пр.
Почему это происходит?
Причины врожденных пороков развития могут быть весьма разнообразны.
Довольно часто причиной являются наследственные факторы, в частности, отклонения в наборе хромосом одного или обоих родителей. Различные вредные факторы, такие как инфекции (корь, ветряная оспа, краснуха, цитомегаловирус), употребление наркотиков или больших доз алкоголя, также могут привести к развитию пороков у плода.
Различные вредные факторы, такие как инфекции (корь, ветряная оспа, краснуха, цитомегаловирус), употребление наркотиков или больших доз алкоголя, также могут привести к развитию пороков у плода.
Часто встречающейся причиной врожденных пороков развития является дефицит витаминов в рационе беременной, в особенности недостаток фолиевой кислоты. Естественно, правильный образ жизни беременной женщины и рацион питания являются немаловажными факторами для развития здорового ребенка. И наоборот, нехватка витаминов часто становится причиной сбоя в развитии умственных и физических способностей малыша.
Влияние негативных факторов окружающей среды: рентгеновских лучей, ионизирующего излучения, атомной энергии и пр. Воздействие химических негативных факторов может привести к гипоксии плода и вызвать формирование врожденных пороков развития плода.
Особую опасность составляют такие вещества, как никотин, ртуть, противозачаточные средства, бензол, лако-красочные вещества и отдельные лекарственные препараты.
Механические факторы, в частности, опухоли матки, неправильное расположение плода, имплантация яйцеклетки могут стать причиной таких аномалий, как спина бифида, отклонения в развитии нервной трубки. Травмы матери в процессе беременности и эндокринные заболевания также являються предрасполагающими факторами формировании ВПР.
Следует отметить, что практически в половине случаев врожденных пороков у плода причины их возникновения остаются невыясненными.
Грубые врожденные пороки развития (ВПР) встречаются у 2-6% новорожденных . База данных Белорусского регистра ВПР ежегодно пополняется более чем 2,5 тысячами наблюдений. Первое место в структуре регистрируемых аномалий развития занимают пороки сердца, на которые в сумме приходится около трети всех диагностированных случаев (1 на 150 новорожденных). Достаточно распространена группа множественных ВПР и хромосомной патологии (1 из 200 новорожденных), а также пороки нервной трубки (1 из 600 новорожденных). Часто встречается расщелина губы/нёба (у 1 из 800 новорожденных).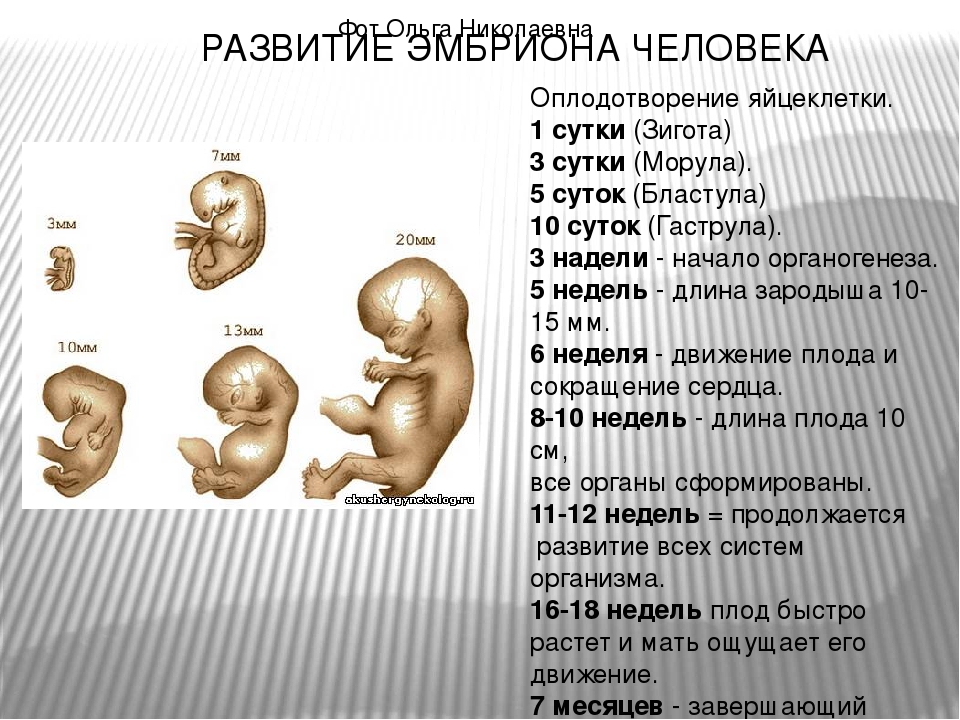 При современном уровне развития пренатальной диагностики свыше ⅓ ВПР диагностируется внутриутробно, что позволяет прервать беременность с такой патологией у плода. В последние годы в Республике прерывается свыше 600 беременностей в связи с выявлением ВПР плода.
При современном уровне развития пренатальной диагностики свыше ⅓ ВПР диагностируется внутриутробно, что позволяет прервать беременность с такой патологией у плода. В последние годы в Республике прерывается свыше 600 беременностей в связи с выявлением ВПР плода.
Как диагностируются врожденные пороки развития?
В наше время, благодаря достижениям современной медицины, возможна ранняя диагностика врожденной патологии во внутриутробном периоде.
Существуют непрямые и прямые методы диагностики врожденных пороков развития плода.
Непрямые методы диагностики врожденных пороков: анализы крови на АФП, ХГЧ, гормоны, иммунологические, серологические, генетические тесты, которые проходят беременные во время первого посещения медико-генетической консультации в сроке до 13нед беременности. На основании результатов этих исследований можно предположить наличие или высокий риск развития врожденных пороков плода.
Помимо этих способов исследования, все беременные проходят неинвазивные прямые методы диагностики врожденных пороков-это ультразвуковое обследование плод(УЗИ), которое проводится 3 раза в течение всего срока беременности, но при необходимости назначают дополнительные процедуры. Так как к 19-20 неделе уже сформированы практически все органы и системы, то видны на УЗИ врожденные пороки развития плода в 80-86% случав .
Информация, полученная после диагностики врожденных пороков, необходима для принятия решения о дальнейшей тактике ведения пациентки:
срочного лечения врожденного порока;
проведения родов в специализированных учреждениях для своевременного лечения врожденных пороков;
прерывание беременности при невозможности лечения врожденного порока и нарушениях, несовместимых с жизнью.
Профилактика врожденных пороков
Большинство беременных женщин впервые обращаются к врачу на сроке 8-10 недель беременности или даже позже, то есть на тех сроках, когда многие потенциально-опасные моменты во внутриутробном развитии уже пройдены.
Около половины всех беременностей наступает не запланировано, зачастую женщины на ранних сроках не знают о своём положении и продолжают вести обычный образ жизни — курить, употреблять алкоголь, принимать разнообразные лекарственные препараты и биологически-активные добавки, нанося вред развитию своего будущего ребенка. Кроме того, в наше время до сих пор имеют место случаи неявки пациенток для постановки на учет по беременности, тем самым лишая возможности свого будущего ребенка, в случае наличия у него ВПР, своевременно провести хирургическое лечение в специализированном медицинской учреждении г.Минска и сохранить ему жизнь.
Идеальной является ситуация, когда женщина обращается за консультацией на стадии планирования беременности. Тогда у врача есть время для проведения всех необходимых исследований, составления индивидуально плана периконцепционной профилактики, который способен обеспечить наилучшие условия для созревания яйцеклетки, ее имплантации и раннего развития эмбриона.
Какие мероприятия необходимо провести, если супружеская пара планирует беременность?
Медико-генетическое обследовaние:
где специалист определяет степень риска развития врожденного порока плода. Чаще всего к генетику обращаются семьи, в которых есть наследственные или врожденные патологии у кого-либо из родственников, либо рождение у семейной пары ребенка с ВПР а также возрастные семейные пары( жена старше 35 лет, муж старше 40 лет), с учетом того, что с возрастом увеличивается риск рождения детей с хромосомными нарушениями. Врач генетик составляет проектирование совокупности генов, позволяющее определить риск формирования врожденного порока развития плода из-за нарушений генетического материала или составления неправильных комбинаций,
определяет носительства мажорных мутаций фенилкетонурии, муковисцидоза, миодистрофии Дюшенна, наследственного рака молочной железы, болезни Тея-Сакса, талассемии, нейросенсорной тугоухости и др., проведение HLA-типирования, определение уровня гомоцистеина в плазме крови.
Исследование на наличие инфекционных заболеваний
ВИЧ, Сифилис, гепатиты В и С, токсоплазмоз, герпес, СМВ, краснуха. Исследование для выявление распространенных инфекций, передаваемых половым путём.
При необходимости — иммунизация против гепатита В, краснухи, ветрянки
При необходимости — лечение хронических инфекционных заболеваний у обоих супругов.
Рекомендации неинфицированным женщинам, как снизить риск заражения вирусными инфекциями и токсоплазмозом: частое мытьё рук, уменьшение контакта с детьми дошкольного возраста, исключение контакта с сырым мясом, открытым грунтом, кошками.
Производственные и средовые вредности
Оценка риска производственных вредностей. Исключение контакта с растворителями, красителями, пестицидами.
Обратить внимание на химические вещества, часто применяемые в быту. Сократить до минимума контакт с ними, при возможности заменить на безопасные аналоги — соду, хозяйственное мыло и т.д.
Общая оценка состояния здоровья
Следует пройти ежегодную диспансеризацию и обсудить с лечащим врачом, какие препараты представляют наименьшую угрозу для развития беременности. Записать названия средств, которые можно принимать во время беременности при повышении температуры, возникновении аллергии и других частых ситуаций.
Посетить стоматолога и вылечить имеющийся кариес;
При наличие хронического заболевания, требующего постоянного приёма лекарств, попросить специалиста выбрать наиболее безопасную схему лечения, и следовать ей
Контроль за состоянием здоровья и вредными привычками
Прекратить курение;
Сократить до минимума количество алкогольных напитков;
Исключить прием наркотических и психотропных веществ;
Ограничить прием кофеин-содержащих напитков двумя чашками в день;
Нормализация питания
Исключить риск дефицита питательных веществ. Обсудить с врачом проблему ограничительных диет, если вы им следуете.
Избегать передозировки витаминов, не превышать дозы:
Витамина А не более 3000 МЕ/день;
Витамина D не более 400 МЕ/день;
Приём фолиевой кислоты в дозе 400 мкг/день для здоровых женщин и 1000 мкг в день для пациенток, страдающих диабетом и эпилепсией. Если у женщины уже есть ребенок, рожденный с дефектами развития нервной трубки, то доза повышается до 4 мг в сутки. Прием фолиевой кислоты необходимо начать за 3 месяцв до зачатия и продолжить первые 3 месяцв беременнсоти;
Помнить, что избыточный вес так же опасен для нормального развития беременности, как и недостаток массы тела;
Нормализовать полноценное разнообразное питание;
Рекомендации по здоровому образу жизни
Придерживаться регулярных умеренных физических упражнений, ввести в правило пешие прогулки на свежем воздухе;
Избегать перегревания: посещения сауны, инфракрасных кабин, солярия, и др.
К сожалению, даже в странах, проводящих активную агитацию, доля беременных, проходящих прегравидарную подготовку согласно рекомендациям, как правило, не превышает одной трети. К моменту, когда женщина осознаёт, что она беременна, многие возможности превентивного характера уже упущены.
Поэтому для повышения эффективности проводимых мер профилактики рождения детей с ВПР прежде всего необходимо существенно увеличить процент запланированных беременности.
Отдельно следует остановиться на хронических заболеваниях, которыми страдают молодые женщины, планирующие беременность.
Сахарный диабет является наиболее полно изученным заболеванием в плане неблагоприятного влияния на протекание беременности. Если женщина, больная сахарным диабетом или имеющая нарушенную толерантность к глюкозе, планирует наступление беременности, она должна получать полноценное лечение по крайней мере за несколько месяцев до предполагаемого зачатия.
Те женщины, в крови которых определяется повышенный уровень гликированного гемоглобина (>8,4%), имеют риск спонтанного прерывания беременности, равный 32%. В случае доношенной беременности в этих случаях риск врожденных аномалий плода превышает 7-кратное значение по сравнению с тем риском, который имеют больные диабетом женщины, чьё заболевание грамотно контролируется.
Лечение сахарного диабета, начатое за несколько месяцев до зачатия, значительно снижает риск невынашивания и врожденных пороков развития. Общими рекомендациями для тех женщин, у которых при планировании беременности выявлены нарушения углеводного обмена, являются:
Применение строгой контрацепции до того момента, когда не будет проведена тщательная диагностика и налажено лечение, позволяющее контролировать уровень сахара в крови;
Следование сбалансированной программе питания, обязательное занятие физическими упражнениями;
Тщательный контроль уровня глюкозы путем регулярного определения фруктозамина или гликированного гемоглобина;
Гипертония во время беременности может провоцировать развитие достаточно серьёзных осложнений. Поэтому в этом случае проводится более тщательный контроль за риском развития преэклампсии, поражения почек и внутриутробной задержки роста плода. Женщины, страдающие гипертонической болезнью, должны избегать незапланированного наступления беременности.
При планировании беременности женщиной, получающей лечение по поводу повышенного давления, лечащий врач должен исключить из схемы терапии препараты с потенциально тератогенным действием. Во время 1-го и 2-го триместра беременности следует отказаться от приема ингибиторов ангиотензин-превращающего фактора, антагонистов рецепторов ангиотензина II и тиазидовых диуретиков. При планировании беременности следует обратиться к врачу для подбора безопасного для плода лечения.
Эпилепсия. Дети, рожденные матерями, страдающими эпилепсией, имеют повышенный риск врожденных аномалий развития. Этот риск может быть обусловлен проводимым противосудорожным лечением или отражать имеющиеся генетические предпосылки.
Женщины, страдающие эпилепсией, должны получать во время беременности адекватное лечение, так как при развитии судорожного эпизода плод испытывает значительную гипоксию.
Наряду с лечением, контролирующим возникновение приступов, необходимо назначать повышенные дозы фолиевой кислоты. Также обязательным является прохождение генетического консультирования для определения риска возникновения эпилепсии у ребенка.
Большое количество препаратов, применяемых для лечения эпилепсии, во время беременности являются небезопасными, в связи с наличием у них тератогенного риска. Оптимальным является назначение одного препарата в минимально возможной дозировке. В случае лечения беременной пациентки с эпилепсией невозможно порекомендовать какой-либо один безопасный препарат. Лечение должно быть тщательно подобрано лечащим врачом.
Общим правилом является избегать назначения новых мало изученных в плане тератогенного риска препаратов.
Тромботические состояния и тромбоэмболия. Те женщины, у которых был эпизод тромбоэмболического или тромботического заболевания, или в семье у которых повышен риск тромбозов, должны пройти тщательное обследование при планировании беременности.
У тех женщин, которые перенесли риск глубокого венозного тромбоза, риск рецидива во время беременности составляет 10%. В таких случаях показано проведения профилактики тромбообразования путём назначения низкомолекулярного гепарина с первых дней беременности. Такое лечение позволяет избежать рецидива тромбоза и осложнений в развитии беременности. Если планирующая беременность женщина получает лечение варфарином, то необходимо заменить этот препарат на гепарин, так как варфарин способен вызывать врожденные аномалии развития плода (варфариновую фетопатию).
Таким образом,индивидуальный план периконцепционной профилактики способен значительно улучшить исходы беременности. Грамотно составленный план будет содержать все необходимые рекомендации по улучшению здоровья семейной пары и созданию оптимальных условий для зачатия и вынашивания ребенка.
Использование различных методов выявления крупных (к гестационному возрасту) размеров плода, для улучшения исходов со стороны здоровья
В чем состоит проблема (вопрос)?
Ребенок (во время внутриутробного развития) иногда может вырасти до размеров, больше ожидаемых, и к моменту рождения набрать высокую массу тела. При подозрении на избыточный внутриутробный рост младенца будущей матери могут потребоваться дополнительные незапланированные дородовые посещения [посещения женской консультации] и обследование для оценки состояния ее здоровья и здоровья ее развивающегося младенца.
Почему это важно?
Обследование может показать, имеются ли признаки какого-либо ухудшения состояния младенца или развития осложнений у матери. Рекомендуемые частота и комбинации видов обследования (тестов) варьируют в локальных протоколах и руководствах. Обследование может включать в себя подсчет движений плода, оценку сердцебиений плода (кардиотокографию), проверку уровня сахара в крови матери или использование ультразвука для определения роста плода, доплеровское ультразвуковое исследование кровеносных сосудов плода и оценку объема жидкости вокруг младенца.
Крупные размеры плода (младенца) связаны с повышенным риском как для матери, так и для младенца, в том числе повышенным риском внутриутробной смерти и мертворождения. При рождении такой ребенок имеет более высокий риск низкого уровня кислорода, дистоции [затрудненных родов] плечиков, повреждения нервов, переломов костей, низкого уровня сахара в крови, а также поступления в отделение интенсивной терапии новорожденных. Материнские осложнения включают затяжные роды, оперативные роды, включая кесарево сечение, травмы промежности, послеродовое кровотечение и разрывы матки.
Вмешательства, которые могут замедлить ускоренный рост плода и улучшить исходы со стороны здоровья матери и ее ребенка, включают в себя рекомендации по питанию, изменению образа жизни, а также контроль уровня глюкозы крови и инсулинотерапию у женщин, страдающих диабетом или гестационным диабетом.
Какие доказательства мы нашли?
Мы провели поиск исследований на 10 августа 2015 года, но не нашли каких-либо рандомизированных контролируемых испытаний, в которых изучали влияние проведения дополнительных тестов (обследования) на исходы со стороны здоровья у беременных женщин с избыточным ростом младенца (плода) на сроке после 20 недель беременности.
Что это значит?
Необходимы рандомизированные контролируемые клинические испытания в этой области с целью информирования клинической практики при выявлении крупного плода/младенца во время беременности, чтобы оценить, могут ли дополнительные тесты (обследование) или наблюдение улучшить здоровье этих женщин и их детей. Также важно определить любой вред, который может быть связан с дополнительным обследованием и наблюдением, т.к. выявление женщин с подозрением на крупный плод может привести к ненужной материнской тревоге в результате дополнительных исследований и вмешательств, включая индукцию родов или кесарева сечения.
Дифференциальная диагностика ранней и поздней форм синдрома задержки развития плода
Синдром задержки развития плода (СЗРП) — это отставание массы плода и его размеров по сравнению с должными по-
казателями для данного срока беременности. Диагностика СЗРП основывается на оценке фетометрических параметров,
согласно которым предполагаемая масса плода должна быть ниже 5-го перцентиля для данного срока беременности.
После рождения диагноз ставится, если масса новорожденного ниже 10-го перцентиля для данного срока беременности.
Данная патология является одной из основных причин перинатальной заболеваемости и смертности.
Выделяют материнские, плацентарные и плодные факторы риска СЗРП. Считается, что основная причина развития
СЗРП — недостаточное поступление питательных веществ и кислорода к плоду, обусловленное нарушением строения
и функционирования плаценты.
Многочисленные исследования показывают, что пренатальная диагностика СЗРП статистически значимо снижает частоту
неблагоприятных перинатальных исходов. Тем не менее, в настоящее время большинство случаев СЗРП остаются не
диагностированными, т.к. не существует единого протокола, регламентирующего сроки и показания к родоразрешению
при данной патологии. Учет клинико-анамнестических данных, ряд биохимических маркеров, показатели допплерометрии
в маточных артериях, артериях пуповины, средней мозговой артерии, церебро-плацентарное отношение (ЦПО) являются
основными диагностическими критериями синдрома задержки внутриутробного роста плода.
Ранняя диагностика СЗРП, своевременное родоразрешение, тщательное наблюдение и профилактика постнатальных
осложнений позволят существенно снизить показатели заболеваемости и смертности новорожденных с синдромом
задержки внутриутробного роста
Ключевые слова: внутриутробная задержка развития плода, факторы риска, патогенез, дифференциальная диагностика
Скрининговое ультразвуковое исследование беременных в I триместре (диагностика нарушений развития плода)
Курс повышения квалификации «Скрининговое ультразвуковое исследование беременных в I триместре (диагностика нарушений развития плода)» (36 ч.)
Авторы курса
Блинов Александр Юрьевич, врач акушер — гинеколог, врач ультразвуковой диагностики, кандидат медицинских наук, доцент, автор более 100 научных работ, в том числе более 10 монографий и авторских свидетельств, член редколлегии журнала «Пренатальная диагностика», рецензируемого ВАК.
Емельяненко Елена Сергеевна, канд. мед. наук, доц. кафедры акушерства, гинекологии и репродуктивной медицины ФНМО Медицинского института Российского университета дружбы народов, эксперт МАРС, руководитель Международной школы УЗИ в практике акушера-гинеколога: От основ к высотам.
Блоки курса
Первый блок
Первый блок будет посвящен нормальной топографической анатомии плода на сроках 11-14 недель – лекция включает подробный разбор алгоритма оценки всех структур плода, доступных к визуализации на этих сроках с их взаиморасположением. А также будет дана эхографическая картина нормы.
Второй блок
Второй блок курса будет посвящен диагностическому потенциалу протокола ультразвукового исследования на сроках 11-14 недель. В лекции будут описаны пороки развития плода, подлежащие ультразвуковой диагностике на этих сроках беременности, с демонстрацией эхограмм и видеоклипов каждого варианта патологии. Акцент сделан на том, что в случае строгого следования алгоритму протокола все перечисленные пороки должны и могут быть диагностированы или хотя бы заподозрены.
Третий блок
Третий блок будет представлен для врачей пренатальной диагностики по выполнению приказа 1130н МЗ РФ в части прогнозирования хромосомных аномалий плода, а также акушерских осложнений, таких как преэклампсия, ЗРП, преждевременные роды.
Будет предложен пошаговый алгоритм действий врача кабинета антенатальной охраны плода, начиная с с получения лицензии для расчета интегрального риска.
Прогнозирование акушерских осложнений и хромосомных аномалий будет рассмотрено как в первом так и во втором триместре, кроме того большое внимание будет уделяться положениям нового порядка оказания акушерско-гинекологической помощи.
Будут разобраны ключевые вопросы реформирования повседневной работы врача пренатальной диагностики, будут рассмотрены такие вопросы как:
— приоритет при точечном несоответствии приказа 1130н и клинических рекомендаций,
— исполнение УЗ протоколов,
— изменения в номенклатуре медицинских услуг,
— показания для выполнения УЗ исследований в третьем триместре беременности.
Будет поставлен соответствующий акцент на выполнение исследований в частных медицинских центрах и клиниках с учетом нового порядка, документах, регламентирующих время выполнения УЗ исследований.
Симуляционный портал
Симуляционный портал — это сервис, в котором врачи ультразвуковой диагностики получают практические навыки удаленно.
Вначале обучающийся получает информацию в виде подробного, снабженного многочисленными комментариями, теоретического лекционного материала в виде презентации.
Далее обучающийся переходит к практической части, которая состоит из нескольких разделов.
Первый раздел – работа с сонограммами по выбранному курсу. Сонограммы включают в себя как норму, так и патологию. В этом разделе на сонограммах обучающемуся необходимо найти определенные структуры. При правильном выборе структура выделится цветом и её можно рассмотреть более детально. При неправильном выборе есть возможность (кнопка) посмотреть правильный вариант.
Данная функция создана для «насмотра» обучающимся определенных сканов.
Второй раздел – измерение определенных структур на предложенных сонораммах. В этом разделе обучающий отрабатывает правильность и точность измерения. Также есть возможность (кнопка) посмотреть правильный вариант измерений.
Третий раздел — интерактивные тесты. Вначале обучающемуся предлагается пройти тесты в режиме «тренировки». Это означает, что, если обучающийся ошибся у него есть возможность увидеть подсказку в виде правильного ответа.
Далее необходимо пройти итоговый тест. Тест состоит из теоретических и практических вопросов.
По окончании курса выдается удостоверение о повышении квалификации на 36 часов.
Развитие плода — обзор
Развитие плода мужской репродуктивной системы
Развитие плода мужской репродуктивной системы требует наличия яичка, способного секретировать два гормона, тестостерон и гормон, ингибирующий Мюллера. Формирование яичка требует действия белка фактора, определяющего семенник (SDF), кодируемого геном Y области, определяющей пол ( SRY ) (Windley and Wilhelm, 2016). Этот фактор заставляет недифференцированную гонаду развиваться в яичко.Если этот фактор отсутствует или является дефектным, семенник не сформируется, и будет получен женский фенотип. Яички плода вырабатывают тестостерон, который стимулирует вольфовы протоки дифференцироваться в мужской репродуктивный тракт, состоящий из придатка яичка, семявыносящего протока, семенных пузырьков и простаты. Тестостерон также вызывает образование полового члена и мошонки, в которые опускаются яички. Тестостерон вырабатывается в семенниках плода клетками Лейдига, а гормон, ингибирующий Мюллериан, вырабатывается клетками Сертоли плода.
Стимулом для производства тестостерона фетальными клетками Лейдига не может быть гипофиз плода, поскольку секреция тестостерона предшествует эффективной секреции ЛГ гипофизом плода. В случае высших приматов ХГЧ может заставлять семенники плода формировать клетки Лейдига, а также стимулировать эти клетки к секреции тестостерона (O’Shaughnessy et al. , 2006). Интересно, что плацентарный ЛГ вырабатывается у непарнокопытных во время беременности и также называется лошадиным ХГ (ЭКГ) (Hoppen, 2009).Эта молекула гликозилирована иначе, чем гипофизарный ЛГ, и имеет более длительный период полужизни, хотя β-субъединица кодируется тем же геном LHB гипофизарного ЛГ. Однако ситуация у других родов млекопитающих должна быть иной, поскольку эти виды не продуцируют гонадотропин плаценты. Фактически, человеческая качественная LH- и hCG-специфическая передача сигналов и синтез стероидов теряются в первичных клетках Лейдига, экспрессирующих рецептор LH грызунов, хотя он сохраняет способность связывания обоих гормонов (Peltoketo et al., 2011). Так или иначе, у грызунов эмбриональные клетки Лейдига кажутся автономными; то есть они синтезируют тестостерон без стимула гонадотропина. У всех видов млекопитающих эмбриональные клетки Лейдига прекращают вырабатывать андрогены вскоре после рождения и, по-видимому, исчезают в интерстиции семенников новорожденных.
Во время полового созревания в период полового созревания взрослые клетки Лейдига формируются из недифференцированных клеток, называемых мезенхимоподобными клетками, в интерстициальных пространствах между семенными канальцами.У крыс эти клетки активно размножаются от 2 до 4 недель после рождения, но их количество уменьшается, что свидетельствует о дифференцировке в новый тип клеток. Предполагается, что интерстициальные клетки, дающие начало взрослой популяции клеток Лейдига, являются частью популяции мезенхимальных клеток, которые в течение жизни матки продуцировали фетальные клетки Лейдига. Тем не менее, эти мезенхимные клетки имеют очень высокий митотический индекс быстрых и множественных делений клеток. Следующее поколение дифференцированных клеток экспрессирует белки взрослой клетки Лейдига, 3β-гидроксилдегидрогеназу и рецепторы ЛГ.Эти последние клетки были названы незрелыми клетками Лейдига, они делятся один раз и продуцируют взрослые клетки Лейдига (Benton et al. , 1995).
Управление производством гонадотропинов с обратной связью. В гипоталамусе нейроны кисспептина стимулируют секрецию гонадолиберина под контролем стероидной обратной связи. Высвобождение ГнРГ является пульсирующим и вызывает выброс ЛГ и ФСГ передней долей гипофиза. В гонадах гонадотропины способствуют образованию гамет и выработке стероидных гормонов, которые, в свою очередь, регулируют высвобождение гонадолиберина по механизму обратной связи.У женщин стероидные гормоны эстрогены и прогестерон оказывают положительную обратную связь на нейроны кисспептина перивентрикулярного ядра, вызывая преовуляторный выброс ГнРГ и ЛГ. Напротив, эстрогены и прогестерон подавляют выработку кисспептина в дугообразном ядре. У мужчин тестостерон оказывает отрицательную обратную связь на нейроны кисспептина дугообразного ядра, а также на нейроны GnRH и гипофиза, ингибируя высвобождение GnRH и гонадотропинов.
Различная эффективность ЛГ и ХГЧ в активации цАМФ.В клетках COS-7, трансфицированных LHCGR, общую продукцию цАМФ оценивали после 3-часовой обработки рекомбинантным LH и hCG. Статистический анализ выявил различную эффективную дозу 50% (ED50) между ЛГ и ХГЧ, демонстрируя, что ХГЧ примерно в пять раз более эффективен, чем ЛГ в индукции образования цАМФ (Среднее ± SEM; U-критерий Манна-Уитни; P <0,05; n = 4). Изображение извлечено и изменено из исходной статьи согласно лицензии Creative Commons Attribution (Casarini et al. , 2012).
Сравнение стероидогенеза клеток Лейдига и тека. В клетках Лейдига холестерин эффективно превращается в тестостерон как основной продукт, получаемый как с помощью андростендиона, так и андростендиола при стимуляции ЛГ. В яичнике клетки гранулезы превращают холестерин в прогестерон и его предшественник прегненолон. Последний является субстратом для выработки прогестерона в желтом теле во время лютеиновой фазы, а также для андрогенов в клетках теки, стимулируемых ЛГ.Андростендион — это первичный продукт клеток теки, который служит субстратом для фермента ароматазы и выработки эстрадиола клетками гранулезы, стимулированными ФСГ. Большие стрелки указывают основные стероидогенные пути, второстепенные пути показаны тонкими стрелками.
Рост плода в экологической эпидемиологии: механизмы, ограничения и обзор связи с биомаркерами непостоянного воздействия химических веществ во время беременности | Здоровье окружающей среды
Альгрен М., Вольфарт Дж., Олсен Л.В., Соренсен Т.И., Мелби М.Вес при рождении и риск рака. Рак. 2007. 110 (2): 412–9.
Артикул
Google Scholar
Баркер Д.Д., Винтер П.Д., Осмонд К., Маргеттс Б., Симмондс С.Дж. Вес в младенчестве и смерть от ишемической болезни сердца. Ланцет. 1989; 2 (8663): 577–80.
CAS
Статья
Google Scholar
Ричардс М., Харди Р., Кух Д., Уодсворт, штат Мэн. Масса тела при рождении, послеродовой рост и когнитивные функции в когорте родившихся в Великобритании.Int J Epidemiol. 2002. 31 (2): 342–8.
Артикул
Google Scholar
Wilcox AJ, Russell IT. Вес при рождении и перинатальная смертность: II. О смертности от удельного веса. Int J Epidemiol. 1983; 12 (3): 319–25.
CAS
Статья
Google Scholar
Бейкер Дж. Л., Олсен Л. В., Соренсен Т. И.. Масса тела при рождении и общая смертность в зрелом возрасте. Эпидемиология. 2008. 19 (2): 197–203.
Артикул
Google Scholar
Баркер DJ. Истоки теории происхождения развития. J Intern Med. 2007. 261 (5): 412–7.
CAS
Статья
Google Scholar
Шрам Р.Дж., Бинкова Б., Деймек Дж., Бобак М. Загрязнение атмосферного воздуха и исходы беременности: обзор литературы. Перспектива здоровья окружающей среды. 2005: 375–82.
Артикул
CAS
Google Scholar
Zheng T, Zhang J, Sommer K, Bassig BA, Zhang X, Braun J и др. Влияние воздействия окружающей среды на траектории роста плода и ребенка. Анналы глобального здравоохранения. 2016; 82 (1): 41–99.
Артикул
Google Scholar
Калафат А.М., Валентин-Блазини Л., Йе Х. Тенденции воздействия химических веществ на средства личной гигиены и потребительские товары. Curr Environ Health Rep. 2015; 2 (4): 348–55.
CAS
Статья
Google Scholar
CDC. Четвертый национальный отчет о воздействии химических веществ в окружающей среде на человека, обновленные таблицы. Атланта, Джорджия, США: Центры по контролю и профилактике заболеваний; 2018.
Боберг Дж., Таксвиг С., Кристиансен С., Хасс У. Возможные эндокринные разрушающие эффекты парабенов и их метаболитов. Reprod Toxicol. 2010. 30 (2): 301–12.
CAS
Статья
Google Scholar
Диаманти-Кандаракис Э., Бургиньон Дж.П., Джудис Л.С., Хаузер Р., Принс Г.С., Сото AM и др.Химические вещества, нарушающие работу эндокринной системы: научное заявление эндокринного общества. Endocr Rev.2009; 30 (4): 293–342.
CAS
Статья
Google Scholar
Calafat AM, Longnecker MP, Koch HM, Swan SH, Hauser R, Goldman LR, et al. Биомаркеры оптимального воздействия нестойких химических веществ в экологической эпидемиологии. Перспектива здоровья окружающей среды. 2015; 123 (7): A166–8.
CAS
Статья
Google Scholar
Брукс А., Джонсон М., Стир П., Поусон М., Абдалла Х. Вес при рождении: природа или воспитание? Early Hum Dev. 1995. 42 (1): 29–35.
CAS
Статья
Google Scholar
Практический бюллетень № 134: Ограничение роста плода. Американский колледж акушеров и гинекологов. Obstet Gynecol. 2013. 121 (5): 1122–33.
Сисей С.М., Прентис А.М., Коул Т.Дж., Фурд Ф., Поскитт Е.М., Уивер Л.Т. и др. Влияние пищевых добавок для матерей на массу тела при рождении и перинатальную смертность в сельских районах Гамбии: 5-летнее рандомизированное контролируемое исследование.Bmj. 1997. 315 (7111): 786–90.
CAS
Статья
Google Scholar
Aghajafari F, Nagulesapillai T, Ronksley PE, Tough SC, O’Beirne M, Rabi DM. Связь между уровнем 25-гидроксивитамина D в сыворотке крови матери и исходами беременности и новорожденных: систематический обзор и метаанализ обсервационных исследований. Bmj. 2013; 346: f1169.
Артикул
Google Scholar
Гальтен-Соренсен М., Андерсен Л. Б., Сперлинг Л., Кристесен ХТ. Уровень 25-гидроксивитамина D у матери и рост костей плода, оцениваемый с помощью ультразвука: систематический обзор. Ультразвуковой акушерский гинекол. 2014; 44 (6): 633–40. https://doi.org/10.1002/uog.13431.
Артикул
Google Scholar
Johns LE, Ferguson KK, Meeker JD. Взаимосвязь между концентрацией метаболита фталата в моче и бисфенолом A и уровнями витамина D у взрослых в США: Национальное исследование здоровья и питания (NHANES), 2005–2010 гг.Журнал клинической эндокринологии и метаболизма. 2016; 101 (11): 4062–9.
CAS
Статья
Google Scholar
Johns LE, Ferguson KK, Cantonwine DE, McElrath TF, Mukherjee B., Meeker JD. Концентрация BPA и фталат-метаболитов в моче и уровни витамина D в плазме у беременных женщин: анализ повторных измерений. Перспектива здоровья окружающей среды. 2017; 125 (8): 087026.
Артикул
Google Scholar
Велосипед ДД. Метаболизм витамина D, механизм действия и клиническое применение. Chem Biol. 2014. 21 (3): 319–29.
CAS
Статья
Google Scholar
Quesnot N, Bucher S, Fromenty B, Robin MA. Модуляция метаболизирующих ферментов бисфенолом а на моделях человека и животных. Chem Res Toxicol. 2014. 27 (9): 1463–73.
CAS
Статья
Google Scholar
Конде-Агудело А., Ромеро Р., Кусанович Дж. П., Хасан СС. Добавки витаминов C и E во время беременности для профилактики преэклампсии и других неблагоприятных исходов для матери и перинатального периода: систематический обзор и метаанализ. Am J Obstet Gynecol. 2011; 204 (6): 503. e1 – e12.
Артикул
CAS
Google Scholar
Ferguson KK, Cantonwine DE, McElrath TF, Mukherjee B, Meeker JD. Повторный анализ измерений ассоциации между концентрацией бисфенола-А в моче и биомаркерами воспаления и оксидативного стресса во время беременности.Reprod Toxicol. 2016; 66: 93–8.
CAS
Статья
Google Scholar
Фергюсон К.К., Макэлрат Т.Ф., Чен Й.Х., Мукерджи Б., Микер Дж. Д.. Метаболиты фталата в моче и биомаркеры окислительного стресса у беременных: анализ повторных измерений. Перспектива здоровья окружающей среды. 2015; 123 (3): 210.
CAS
Статья
Google Scholar
Dosek A, Ohno H, Acs Z, Taylor AW, Radak Z.Большая высота и окислительный стресс. Respir Physiol Neurobiol. 2007. 158 (2): 128–31.
CAS
Статья
Google Scholar
Крампл Э., Лис К., Бланд Дж., Эспиноза Дорадо Дж., Москосо Дж., Кэмпбелл С. Биометрия плода на высоте 4300 м по сравнению с уровнем моря в Перу. Ультразвуковой акушерский гинекол. 2000. 16 (1): 9–18.
CAS
Статья
Google Scholar
Wilcox AJ. О важности — и неважности — веса при рождении.Int J Epidemiol. 2001. 30 (6): 1233–41.
CAS
Статья
Google Scholar
Десаи М., тер Куиле Ф.О., Ностен Ф., МакГриди Р., Асамоа К., Брабин Б., Ньюман Р.Д. Эпидемиология и бремя малярии у беременных. Lancet Infect Dis. 2007. 7 (2): 93–104.
Артикул
Google Scholar
Перейра Л., Петитт М., Фонг А., Цуге М., Табата Т., Фанг-Гувер Дж. И др. Ограничение внутриутробного развития, вызванное основной врожденной цитомегаловирусной инфекцией.J Infect Dis. 2014. 209 (10): 1573–84.
CAS
Статья
Google Scholar
Эрнст Г.Д., де Йонге Л.Л., Хофман А., Линдеманс Дж., Рассчер Х., Стиегерс Э.А. и др. Уровни С-реактивного белка на ранних сроках беременности, модели роста плода и риск неонатальных осложнений: исследование поколения R. Am J Obstet Gynecol. 2011; 205 (2): 132. e1 – e12.
Артикул
CAS
Google Scholar
Ferguson KK, Kamai EM, Cantonwine DE, Mukherjee B, Meeker JD, McElrath TF. Связь между повторными ультразвуковыми измерениями роста плода и биомаркерами материнского оксидативного стресса и воспаления во время беременности. Am J Reprod Immunol. 2018; 80 (4): e13017.
Артикул
CAS
Google Scholar
Cotechini T, Hopman WJ, Graham CH. Вызванное воспалением ограничение роста плода у крыс связано с изменением морфометрии плаценты.Плацента. 2014; 35 (8): 575–81.
CAS
Статья
Google Scholar
Котечини Т., Комисаренко М., Сперу А., Макдональд-Гудфеллоу С., Адамс М.А., Грэм Ч. Воспаление при беременности крыс препятствует ремоделированию спиральной артерии, что приводит к задержке роста плода и признакам преэклампсии. J Exp Med. 2014; 211: 165–79.
CAS
Статья
Google Scholar
Уоткинс DJ, Фергюсон К.К., Дель Торо LVA, Альшавабке А.Н., Кордеро Дж. Ф., Микер Дж. Д.. Связь между концентрацией фенола и парабенов в моче и маркерами окислительного стресса и воспаления у беременных женщин в Пуэрто-Рико. Int J Hyg Environ Health. 2015; 218 (2): 212–9.
CAS
Статья
Google Scholar
Shelton JF, Hertz-Picciotto I, Pessah IN. Изменение баланса риска аутизма: потенциальные механизмы, связывающие пестициды и аутизм.Перспектива здоровья окружающей среды. 2012; 120 (7): 944.
Артикул
Google Scholar
Резник Р. Ограничение внутриутробного развития. Obstet Gynecol. 2002. 99 (3): 490–6.
Google Scholar
Андрес Р.Л., День M-C. Перинатальные осложнения, связанные с употреблением табака матерью. Semin Neonatol. 2000. 5 (3): 231–41.
CAS
Статья
Google Scholar
Мерфи В.Е., Смит Р., Джайлз В.Б., Клифтон В.Л. Эндокринная регуляция роста плода человека: роль матери, плаценты и плода. Endocr Rev.2006; 27 (2): 141–69.
Артикул
Google Scholar
Вернер Э.Ф., Браун Дж. М., Йолтон К., Хури Дж. К., Ланфер Б. П.. Связь между концентрацией фталата в моче матери и артериальным давлением во время беременности: исследование HOME. Здоровье окружающей среды. 2015; 14 (1): 75.
Артикул
CAS
Google Scholar
Bae S, Kim JH, Lim YH, Park HY, Hong YC. Связь воздействия бисфенола А с вариабельностью сердечного ритма и артериальным давлением. Гипертония. 2012; 60 (3): 786–93.
CAS
Статья
Google Scholar
Trasande L, Sathyanarayana S, Spanier AJ, Trachtman H, Attina TM, Urbina EM. Фталаты в моче связаны с повышением артериального давления в детстве. J Pediatr. 2013. 163 (3): 747–53. e1.
CAS
Статья
Google Scholar
Gore AC, Chappell VA, Fenton SE, Flaws JA, Nadal A, Prins GS и др. EDC-2: Второе научное заявление эндокринного общества о химических веществах, нарушающих работу эндокринной системы. Endocr Rev.2015; 36 (6): E1 – E150.
CAS
Статья
Google Scholar
Коуэлл В.Дж., Райт Р.Дж. Специфические для пола эффекты комбинированного воздействия химических и нехимических стрессоров на нейроэндокринное развитие: обзор последних результатов и предполагаемых механизмов.Curr Environ Health Rep., 2017; 4 (4): 415–25.
CAS
Статья
Google Scholar
Комфорт N, Re DB. Специфические для пола нейротоксические эффекты фосфорорганических пестицидов на протяжении всей жизни. Curr Environ Health Rep., 2017; 4 (4): 392–404.
CAS
Статья
Google Scholar
Fowden AL. Эндокринная регуляция роста плода. Reprod Fertil Dev. 1995. 7 (3): 351–63.
CAS
Статья
Google Scholar
Форхэд А.Дж., Фоуден А.Л. Гормоны щитовидной железы при росте плода и предродовом созревании. J Endocrinol. 2014; 221 (3): R87 – R103.
CAS
Статья
Google Scholar
Берроу Г.Н., Фишер Д.А., Ларсен ПР. Функция щитовидной железы матери и плода. N Engl J Med. 1994. 331 (16): 1072–8.
CAS
Статья
Google Scholar
Gicquel C, Le Bouc Y. Гормональная регуляция роста плода. Horm Res. 2006; 65 (Дополнение 3): 28–33.
CAS
Статья
Google Scholar
Лин СС, Сантолая-Форгас Дж. Современные концепции ограничения роста плода: Часть I. Причины, классификация и патофизиология. Obstet Gynecol. 1998 декабрь; 92 (6): 1044–55.
CAS
Google Scholar
Mainigi MA, Olalere D, Burd I, Sapienza C, Bartolomei M, Coutifaris C.Гормональная среда периимплантации: выяснение механизмов аномальной плацентации и роста плода. Биол Репрод. 2014; 90 (2): 26.
Шолль Т.О., Соуэрс М., Чен Х, Лендерс С. Концентрация материнской глюкозы влияет на рост плода, гестацию и осложнения беременности. Am J Epidemiol. 2001. 154 (6): 514–20.
CAS
Статья
Google Scholar
Jolly MC, Sebire NJ, Harris JP, Regan L, Robinson S.Факторы риска макросомии и ее клинические последствия: исследование 350 311 беременностей. Eur J Obstet Gynecol Reprod Biol. 2003. 111 (1): 9–14.
Артикул
Google Scholar
Jauniaux E, Poston L, Burton GJ. Плацентарные заболевания беременности: участие окислительного стресса и последствия для эволюции человека. Обновление Hum Reprod. 2006. 12 (6): 747–55.
CAS
Статья
Google Scholar
Фауден А.Л., Сибли С., Рейк В., Констанция М. Запечатленные гены, развитие плаценты и рост плода. Horm Res. 2006; 65 (Дополнение 3): 50–8.
CAS
Статья
Google Scholar
Констанция М., Хембергер М., Хьюз Дж., Дин В. Плацентарный IGF-II является основным модулятором роста плаценты и плода. Природа. 2002; 417 (6892): 945.
Артикул
CAS
Google Scholar
Hoyo C, Murtha AP, Schildkraut JM, Jirtle RL, Demark-Wahnefried W., Forman MR, et al. Вариации метилирования в дифференциально метилированных областях IGF2 и использование материнской фолиевой кислоты до и во время беременности. Эпигенетика. 2011; 6 (7): 928–36.
CAS
Статья
Google Scholar
ЛаРокка Дж., Биндер А.М., Макэлрат Т.Ф., Михельс КБ. Влияние воздействия фталата и фенола в первом триместре на геномный импринтинг IGF2 / h29 и исходы родов.Environ Res. 2014; 133: 396–406.
CAS
Статья
Google Scholar
Susiarjo M, Sasson I, Mesaros C, Bartolomei MS. Воздействие бисфенола а нарушает геномный импринтинг у мышей. PLoS Genet. 2013; 9 (4): e1003401.
CAS
Статья
Google Scholar
ЛаРокка Дж., Биндер А.М., Макэлрат Т.Ф., Михельс КБ. Концентрации фталатных метаболитов и фенолов в моче в первом триместре и экспрессия миРНК в плаценте в когорте U.С. Женщины. Перспектива здоровья окружающей среды. 2016; 124 (3): 380–7.
CAS
Статья
Google Scholar
Сингх С., Ли СС. Эпигенетические эффекты химических веществ окружающей среды бисфенола А и фталатов. Int J Mol Sci. 2012. 13 (8): 10143–53.
CAS
Статья
Google Scholar
Meyer JN, Leung MC, Rooney JP, Sendoel A, Hengartner MO, Kisby GE, et al. Митохондрии как мишень экологических токсикантов.Toxicol Sci. 2013; 134 (1): 1–17.
CAS
Статья
Google Scholar
Латтуада Д., Коллеони Ф., Мартинелли А., Гарретто А., Магни Р., Радаэлли Т. и др. Повышенное содержание митохондриальной ДНК в плаценте ЗВУР человека. Плацента. 2008. 29 (12): 1029–33.
CAS
Статья
Google Scholar
Mandò C, De Palma C, Stampalija T, Anelli GM, Figus M, Novielli C, Parisi F, Clementi E, Ferrazzi E, Cetin I.Состав и функция митохондрий плаценты при задержке внутриутробного развития и преэклампсии. Am J Physiol Endocrinol Metab. 2014; 306 (4): E404–13.
Артикул
CAS
Google Scholar
Janssen BG, Munters E, Pieters N, Smeets K, Cox B, Cuypers A, et al. Содержание митохондриальной ДНК плаценты и загрязнение воздуха частицами во время внутриутробной жизни. Перспектива здоровья окружающей среды. 2012; 120 (9): 1346.
CAS
Статья
Google Scholar
Vriens A, Nawrot TS, Baeyens W., Den Hond E, Bruckers L, Covaci A, et al. Воздействие на новорожденных загрязнителей окружающей среды и содержания митохондриальной ДНК плаценты: подход с множеством загрязнителей. Environ Int. 2017; 106: 60–8.
CAS
Статья
Google Scholar
Clemente DB, Casas M, Vilahur N, Begiristain H, Bustamante M, Carsin A-E, et al. Пренатальное загрязнение окружающего воздуха, содержание митохондриальной ДНК плаценты и масса тела при рождении в когортах новорожденных INMA (Испания) и ENVIRONAGE (Бельгия).Перспектива здоровья окружающей среды. 2016; 124 (5): 659.
CAS
Статья
Google Scholar
Фишер С.Е., Аткинсон М., Ван Тиль Д.Х. Избирательное недоедание плода: влияние никотина, этанола и ацетальдегида на in vitro поглощение альфа-аминоизобутириевой кислоты срезами ворсинок плаценты у человека. Dev Pharmacol Ther. 1984; 7: 229–38.
CAS
Статья
Google Scholar
Pastrakuljic A, Derewlany L, Koren G. Употребление кокаина матерями и курение сигарет во время беременности в связи с транспортом аминокислот и ростом плода. Плацента. 1999. 20 (7): 499–512.
CAS
Статья
Google Scholar
Ньюберн Д., Фримарк М. Плацентарные гормоны и контроль материнского метаболизма и роста плода. Curr Opin Endocrinol Diabetes Obes. 2011. 18 (6): 409–16.
CAS
Статья
Google Scholar
Sant KE, Dolinoy DC, Jilek JL, Sartor MA, Harris C. Моно-2-этилгексилфталат нарушает нейруляцию и изменяет окислительно-восстановительную среду эмбриона и экспрессию генов. Reprod Toxicol. 2016; 63: 32–48.
CAS
Статья
Google Scholar
Каваи М., Свон К.Ф., Грин А.Е., Эдвардс Д.Е., Андерсон МБ, Хенсон М.С. Нарушение эндокринной системы плаценты, вызванное кадмием: влияние на расщепление боковой цепи холестерина P450 и ферменты 3β-гидроксистероид дегидрогеназы в культивируемых трофобластах человека.Биол Репрод. 2002. 67 (1): 178–83.
CAS
Статья
Google Scholar
Шамс М., Килби М., Сомерсет Д., Хоуи А., Гупта А., Вуд П. и др. 11-Бета-гидроксистероид дегидрогеназа 2 типа при беременности человека и снижение экспрессии при ограничении внутриутробного развития. Hum Reprod (Оксфорд, Англия). 1998; 13 (4): 799-804.
CAS
Статья
Google Scholar
Атанасов А.Г., Там С., Рекен Дж.М., Бейкер М.Э., Одерматт А.Ингибирование 11β-гидроксистероиддегидрогеназы 2 типа дитиокарбаматами. Biochem Biophys Res Commun. 2003. 308 (2): 257–62.
CAS
Статья
Google Scholar
Ma X, Lian Q-Q, Dong Q, Ge R-S. Экологические ингибиторы 11β-гидроксистероиддегидрогеназы 2 типа. Токсикология. 2011. 285 (3): 83–9.
CAS
Статья
Google Scholar
Hendrix N, Berghella V.Неплацентарные причины ограничения внутриутробного развития. Семин Перинатол. 2008. 32 (3): 161–5.
Артикул
Google Scholar
Brent RL. Экологические причины врожденных пороков развития человека: роль педиатра в решении этих сложных клинических проблем, вызванных множеством экологических и генетических факторов. Педиатрия. 2004. 113 (4 Suppl): 957–68.
Perera FP, Jedrychowski W, Rauh V, Whyatt RM.Молекулярно-эпидемиологические исследования воздействия загрязнителей окружающей среды на плод. Перспектива здоровья окружающей среды. 1999; 107 (Дополнение 3): 451.
CAS
Статья
Google Scholar
Lin L-C, Wang S-L, Chang Y-C, Huang P-C, Cheng J-T, Su P-H, et al. Связь между воздействием фталата на мать и половыми гормонами пуповины у младенцев. Chemosphere. 2011; 83 (8): 1192–9.
CAS
Статья
Google Scholar
Араки А., Мицуи Т., Мияшита С., Накадзима Т., Наито Н., Ито С. и др. Связь между воздействием ди (2-этилгексил) фталата на мать и уровнями репродуктивных гормонов в крови плода: исследование окружающей среды и здоровья детей на Хоккайдо. PLoS One. 2014; 9 (10): e109039.
Артикул
CAS
Google Scholar
Романо М.Э., Элиот М.Н., Зеллер Р.Т., Хофнэгл А.Н., Калафат А.М., Карагас М.Р. и др. Метаболиты фталата в моче матери во время беременности и концентрации гормонов щитовидной железы в сыворотке крови матери и пуповины: исследование HOME.Int J Hyg Environ Health. 2018; 221 (4): 623–31.
CAS
Статья
Google Scholar
Дин А., Шарп Р.М. Клинический обзор: аногенитальное расстояние или соотношение длины пальцев как меры воздействия андрогенов на плод: связь с репродуктивным развитием мужчин и его нарушениями. J Clin Endocrinol Metab. 2013. 98 (6): 2230–8.
CAS
Статья
Google Scholar
Ричиарди Л., Беллокко Р., Зугна Д. Анализ медиации в эпидемиологии: методы, интерпретация и систематическая ошибка. Int J Epidemiol. 2013; 42 (5): 1511–9.
Артикул
Google Scholar
Calafat AM, Koch HM, Swan SH, Hauser R, Goldman LR, Lanphear BP, et al. Неправильное использование сыворотки крови для оценки воздействия бисфенола А и фталатов. Рак молочной железы Res. 2013; 15 (5): 403.
Артикул
Google Scholar
EPA. План действий по фталатам (пересмотренный): Агентство по охране окружающей среды США; 2012 [Доступно по адресу: https://www.epa.gov/sites/production/files/2015-09/documents/phthalates_actionplan_revised_2012-03-14.pdf.
Роджерс К.М., Рудель Р.А., Just AC. Фталаты в упаковке пищевых продуктов, потребительских товарах и в помещениях. 2014. В: Токсиканты в упаковке для пищевых продуктов и бытовых пластмассах [Интернет]. Лондон: Springer-Verlag. 1. Молекулярная и интегративная токсикология. Доступно по адресу: https: // www.springer.com/us/book/9781447164999.
Zota AR, Calafat AM, Woodruff TJ. Временные тенденции воздействия фталатов: результаты Национального исследования здоровья и питания, 2001-2010 гг. Перспектива здоровья окружающей среды. 2014. 122 (3): 235–41.
Артикул
Google Scholar
Schwedler G, Seiwert M, Fiddicke U, Issleb S, Holzer J, Nendza J, et al. Пилотное исследование человеческого биомониторинга DEMOCOPHES в Германии: вклад в гармонизированный европейский подход.Int J Hyg Environ Health. 2017; 220 (4): 686–96.
Артикул
Google Scholar
Wolff MS, Engel SM, Berkowitz GS, Ye X, Silva MJ, Zhu C, et al. Пренатальное воздействие фенола и фталата и исходы родов. Перспектива здоровья окружающей среды. 2008. 116 (8): 1092–7.
CAS
Статья
Google Scholar
Колачино Дж. А., Харрис Т. Р., Шектер А. Потребление с пищей связано с фталатной нагрузкой на организм в национальной репрезентативной выборке.Перспектива здоровья окружающей среды. 2010. 118 (7): 998–1003.
CAS
Статья
Google Scholar
Zota AR, Phillips CA, Mitro SD. Недавнее потребление фаст-фуда и воздействие бисфенола А и фталатов среди населения США в NHANES, 2003-2010 гг. Перспектива здоровья окружающей среды. 2016; 124 (10): 1521–8.
CAS
Статья
Google Scholar
Braun JM, Just AC, Williams PL, Smith KW, Calafat AM, Hauser R.Использование средств личной гигиены и концентрация метаболитов фталата и парабенов в моче во время беременности среди женщин из клиники репродуктивного здоровья. J Expo Sci Environ Epidemiol. 2014; 24 (5): 459–66.
CAS
Статья
Google Scholar
Харлей К.Г., Когут К., Мадригал Д.С., Карденас М., Вера И.А., Меза-Альфаро Г. и др. Снижение воздействия фталатов, парабенов и фенолов из средств личной гигиены у девочек-подростков: результаты исследования HERMOSA Intervention Study.Перспектива здоровья окружающей среды. 2016; 124 (10): 1600–7.
CAS
Статья
Google Scholar
Сильва М.Дж., Барр Д.Б., Рейди Дж.А., Малек Н.А., Ходж С.К., Каудилл С.П. и др. Уровни семи метаболитов фталата в моче у населения США по данным Национального исследования здоровья и питания (NHANES) 1999-2000 гг. Перспектива здоровья окружающей среды. 2004. 112 (3): 331–8.
CAS
Статья
Google Scholar
Suzuki Y, Niwa M, Yoshinaga J, Mizumoto Y, Serizawa S, Shiraishi H. Пренатальное воздействие эфиров фталата и ПАУ и исходы родов. Environ Int. 2010. 36 (7): 699–704.
CAS
Статья
Google Scholar
Philippat C, Mortamais M, Chevrier C, Petit C, Calafat AM, Ye X, et al. Воздействие фталатов и фенолов во время беременности и размер потомства при рождении. Перспектива здоровья окружающей среды. 2012; 120 (3): 464–70.
CAS
Статья
Google Scholar
Чжао Ю., Чен Л., Ли LX, Се СМ, Ли Д., Ши Х.Дж. и др. Гендерная взаимосвязь между пренатальным воздействием фталатов и ограничением внутриутробного развития. Pediatr Res. 2014. 76 (4): 401–8.
CAS
Статья
Google Scholar
Смарр М.М., Грантц К.Л., Сундарам Р., Майсог Д.М., Каннан К., Луис Г.М. Родительские мочевые биомаркеры воздействия бисфенола А и фталатов до зачатия в зависимости от исходов родов. Здоровье окружающей среды.2015; 14: 73.
Артикул
CAS
Google Scholar
Боттон Дж., Филиппат К., Калафат А.М., Карлес С., Чарльз М.А., Слама Р. и др. Воздействие фталатов при беременности и рост потомства мужского пола от внутриутробного периода до пятилетнего возраста. Environ Res. 2016; 151: 601–9.
CAS
Статья
Google Scholar
Касас М., Валви Д., Бальестерос-Гомес А., Гаскон М., Фернандес М. Ф., Гарсия-Эстебан Р. и др.Воздействие бисфенола А и фталатов во время беременности и ультразвуковые измерения роста плода в когорте INMA-Sabadell. Перспектива здоровья окружающей среды. 2016; 124 (4): 521–8.
CAS
Статья
Google Scholar
Фергюсон К.К., Микер Д.Д., Кантонвин, Делавэр, Чен Ю.Х., Мукерджи Б., Макэлрат Т.Ф. Связь метаболита фталата в моче и бисфенола А с ультразвуковыми показателями и показателями роста плода. Environ Int. 2016; 94: 531–7.
CAS
Статья
Google Scholar
Фергюсон К.К., Макэлрат Т.Ф., Ко Я.А., Мукерджи Б., Микер Дж.Д. Исправление к: «Связь метаболита фталата в моче и бисфенола А с ультразвуковыми исследованиями и показателями роста плода» [Environment International 94 (2016) 531-537]. Environ Int. 2019; 122: 416.
Артикул
Google Scholar
Polanska K, Ligocka D, Sobala W, Hanke W.Влияние воздействия фталатов из окружающей среды на продолжительность беременности и исходы родов. Int J Occup Med Environ Health. 2016; 29 (4): 683–97.
Артикул
Google Scholar
Sathyanarayana S, Barrett E, Nguyen R, Redmon B, Haaland W, Swan SH. Воздействие фталатов в первом триместре и масса тела ребенка при рождении в исследовании развития ребенка и окружающей среды. Int J Environ Res Public Health. 2016; 13: 10.
Артикул
CAS
Google Scholar
Shoaff JR, Romano ME, Yolton K, Lanphear BP, Calafat AM, Braun JM. Пренатальное воздействие фталатов и размер младенца при рождении и сроке гестации. Environ Res. 2016; 150: 52–8.
CAS
Статья
Google Scholar
Уоткинс Д. Д., Милевски С., Домино С. Е., Микер Дж. Д., Падманабхан В. Воздействие фталатов на матери во время ранней беременности и во время родов в зависимости от гестационного возраста и размера при рождении: предварительный анализ.Reprod Toxicol. 2016; 65: 59–66.
CAS
Статья
Google Scholar
Гао Х, Сюй Ю., Хуанг К., Ге Х, Чжан Ю.В., Яо Х.Й и др. Оценка совокупного риска фталатов, связанного с исходами родов у беременных китайских женщин: проспективное когортное исследование. Загрязнение окружающей среды. 2017; 222: 549–56.
CAS
Статья
Google Scholar
Хуанг Ю.Ф., Пан В.С., Цай Я.А., Чанг С.Х., Чен П.Дж., Шао Ю.С. и др.Одновременное воздействие нонилфенола, бисфенола А, фталатов и фосфорорганических пестицидов на исходы родов: когортное исследование в Тайбэе, Тайвань. Sci Total Environ. 2017; 607-608: 1126–35.
CAS
Статья
Google Scholar
Messerlian C, Braun JM, Minguez-Alarcon L, Williams PL, Ford JB, Mustieles V, et al. Концентрация метаболитов фталата в моче отца и матери и масса тела при рождении одиночек, зачатых парами с субфертильными формами.Environ Int. 2017; 107: 55–64.
CAS
Статья
Google Scholar
Woods MM, Lanphear BP, Braun JM, McCandless LC. Гестационное воздействие химических веществ, нарушающих работу эндокринной системы, в зависимости от массы тела ребенка при рождении: байесовский анализ исследования HOME. Здоровье окружающей среды. 2017; 16 (1): 115.
Артикул
CAS
Google Scholar
Chiu YH, Bellavia A, James-Todd T., Correia KF, Valeri L, Messerlian C и др.Оценка влияния пренатального воздействия смесей фталатов на массу тела при рождении: сравнение трех статистических подходов. Environ Int. 2018; 113: 231–9.
CAS
Статья
Google Scholar
Zhang YW, Gao H, Mao LJ, Tao XY, Ge X, Huang K, et al. Влияние воздействия фталата в течение трех периодов беременности на массу тела при рождении и их гендерные различия: когортное исследование новорожденных в Китае. Sci Total Environ. 2018; 613-614: 1573-8.
CAS
Статья
Google Scholar
Zhu Y, Wan Y, Zhang B, Zhou A, Huo W., Wu C, et al. Взаимосвязь между воздействием фталата на мать и размером потомства при рождении. Sci Total Environ. 2018; 612: 1072–8.
CAS
Статья
Google Scholar
Brucker-Davis F, Wagner-Mahler K, Bornebusch L, Delattre I, Ferrari P, Gal J, et al. Воздействие отдельных эндокринных разрушителей и неонатальный исход у 86 здоровых мальчиков из Ниццы (Франция).Chemosphere. 2010. 81 (2): 169–76.
CAS
Статья
Google Scholar
de Cock M, De Boer MR, Lamoree M, Legler J, Van De Bor M. Пренатальное воздействие эндокринных разрушающих химических веществ и масса тела при рождении — проспективное когортное исследование. J Environ Sci Health A Tox Hazard Subst Environ Eng. 2016; 51 (2): 178–85.
Артикул
CAS
Google Scholar
Govarts E, Remy S, Bruckers L, Den Hond E, Sioen I, Nelen V, et al.Комбинированные эффекты пренатального воздействия химических веществ из окружающей среды на массу тела при рождении. Int J Environ Res Public Health. 2016; 13: 5.
Артикул
CAS
Google Scholar
Хуанг Й., Ли Дж., Гарсия Дж. М., Линь Х, Ван И, Ян П. и др. Уровни фталатов в пуповинной крови связаны с преждевременными родами и параметрами роста плода у китаянок. PLoS One. 2014; 9 (2): e87430.
Артикул
CAS
Google Scholar
Latini G, De Felice C, Presta G, Del Vecchio A, Paris I, Ruggieri F и др. Воздействие ди- (2-этилгексил) фталата в утробе матери и продолжительность беременности человека. Перспектива здоровья окружающей среды. 2003. 111 (14): 1783–5.
CAS
Статья
Google Scholar
Li B, Xu X, Zhu Y, Cao J, Zhang Y, Huo X. Экспрессия неонатального эфира фталата индуцировала экспрессию плацентарных MTs, FATP1 и HFABP мРНК в двух районах юго-восточного Китая. Научный представитель2016; 6: 21004.
CAS
Статья
Google Scholar
Чжан И, Линь Л., Цао И, Чен Б., Чжэн Л., Ге RS. Уровни фталатов и низкий вес при рождении: вложенное исследование случай-контроль китайских новорожденных. J Pediatr. 2009. 155 (4): 500–4.
CAS
Статья
Google Scholar
Lenters V, Portengen L, Rignell-Hydbom A, Jonsson BA, Lindh CH, Piersma AH, et al.Пренатальное воздействие фталата, перфторалкиловой кислоты и хлорорганических соединений, а также предполагаемая масса тела при рождении в трех когортах рождения: модели с несколькими загрязнителями, основанные на эластичной чистой регрессии. Перспектива здоровья окружающей среды. 2016; 124 (3): 365–72.
CAS
Статья
Google Scholar
Минатоя М., Араки А., Мияшита С., Сасаки С., Гото Ю., Накадзима Т. и др. Пренатальное воздействие ди-2-этилгексилфталата, уровни адипокинов в пуповинной крови и размер тела при рождении: исследование окружающей среды и здоровья детей на Хоккайдо.Sci Total Environ. 2017; 579: 606–11.
CAS
Статья
Google Scholar
Xie C, Jin R, Zhao Y, Lin L, Li L, Chen J, et al. Полиморфизм гена параоксоназы 2 и пренатальное воздействие фталатов у китайских новорожденных. Environ Res. 2015; 140: 354–9.
CAS
Статья
Google Scholar
Huang PC, Kuo PL, Chou YY, Lin SJ, Lee CC. Связь между пренатальным воздействием фталатов и здоровьем новорожденных.Environ Int. 2009. 35 (1): 14–20.
Артикул
CAS
Google Scholar
Kim JH, Park H, Lee J, Cho G, Choi S, Choi G, et al. Связь диэтилгексилфталата с маркерами ожирения и изменением массы тела от рождения до 3-месячного возраста. J Epidemiol Community Health. 2016; 70 (5): 466–72.
Артикул
Google Scholar
Чжао Й., Ши Х. Дж., Се СМ, Чен Дж., Лауэ Х., Чжан Я. Х.Пренатальное воздействие фталата, рост ребенка и глобальное метилирование ДНК плаценты человека. Environ Mol Mutagen. 2015; 56 (3): 286–92.
CAS
Статья
Google Scholar
Frederiksen H, Jensen TK, Jorgensen N, Kyhl HB, Husby S, Skakkebaek NE, et al. Выделение человеком с мочой нестойких химических веществ из окружающей среды: обзор датских данных, собранных в период с 2006 по 2012 год. Воспроизведение. 2014. 147 (4): 555–65.
CAS
Статья
Google Scholar
Haines DA, Saravanabhavan G, Werry K, Khoury C. Обзор биомониторинга человека химических веществ в окружающей среде в Канадском обследовании показателей здоровья: 2007-2019. Int J Hyg Environ Health. 2017; 220 (2 Pt A): 13–28.
CAS
Статья
Google Scholar
Кан Х.С., Кюнг М.С., Ко А., Пак Дж. Х., Хван М. С., Квон Дж. Э. и др. Концентрации парабенов в моче и их связь с демографическими факторами: популяционное поперечное исследование.Environ Res. 2016; 146: 245–51.
CAS
Статья
Google Scholar
EPA. План действий по бисфенолу А: Агентство по охране окружающей среды США; 2010 [Доступно по адресу: https://www.epa.gov/sites/production/files/2015-09/documents/bpa_action_plan.pdf.
Рубин Б.С. Бисфенол А: эндокринный разрушитель с широко распространенным воздействием и множественными эффектами. J Стероид Biochem Mol Biol. 2011; 127 (1-2): 27–34.
CAS
Статья
Google Scholar
Vandenberg LN, Chahoud I, Heindel JJ, Padmanabhan V, Paumgartten FJ, Schoenfelder G. Исследования биомониторинга мочи, кровообращения и тканей указывают на широко распространенное воздействие бисфенола A. С точки зрения здоровья окружающей среды. 2010. 118 (8): 1055–70.
CAS
Статья
Google Scholar
Сони М.Г., Карабин И.Г., Лопух Г.А. Оценка безопасности сложных эфиров п-гидроксибензойной кислоты (парабенов). Food Chem Toxicol. 2005. 43 (7): 985–1015.
CAS
Статья
Google Scholar
Calafat AM, Wong LY, Ye X, Reidy JA, Needham LL. Концентрации солнцезащитного агента бензофенона-3 у жителей Соединенных Штатов: Национальное исследование здоровья и питания 2003-2004 гг. Перспектива здоровья окружающей среды. 2008. 116 (7): 893–7.
CAS
Статья
Google Scholar
Bedoux G, Roig B, Thomas O, Dupont V, Le Bot B. Возникновение и токсичность антимикробного триклозана и побочных продуктов в окружающей среде.Environ Sci Pollut Res Int. 2012. 19 (4): 1044–65.
CAS
Статья
Google Scholar
Данн А.Б., Хонтела А. Триклозан: воздействие окружающей среды, токсичность и механизмы действия. J Appl Toxicol. 2011. 31 (4): 285–311.
CAS
Статья
Google Scholar
Ye X, Zhou X, Furr J, Ahn KC, Hammock BD, Gray EL, et al. Биомаркеры воздействия триклокарбана в моче и сыворотке.Токсикология. 2011; 286 (1-3): 69–74.
CAS
Статья
Google Scholar
Ye X, Wong LY, Zhou X, Calafat AM. Концентрации 2,4-дихлорфенола и 2,5-дихлорфенола в моче среди населения США (Национальное исследование здоровья и питания, 2003-2010 гг.): Тенденции и предикторы. Перспектива здоровья окружающей среды. 2014; 122 (4): 351–5.
CAS
Статья
Google Scholar
Купер Е.М., Крегер Г., Дэвис К., Кларк С.Р., Фергюсон П.Л., Стэплтон Х.М. Результаты скрининга потребительских товаров на основе пенополиуретана на предмет наличия огнестойких химикатов: оценка воздействия на изменение стандартов воспламеняемости мебели. Environ Sci Technol. 2016; 50 (19): 10653–60.
CAS
Статья
Google Scholar
Кадзивара Н., Нома Ю., Такигами Х. Бромированные и фосфорорганические антипирены в избранных потребительских товарах на японском рынке в 2008 году.J Hazard Mater. 2011; 192 (3): 1250–9.
CAS
Статья
Google Scholar
Mendelsohn E, Hagopian A, Hoffman K, Butt CM, Lorenzo A, Congleton J, et al. Лак для ногтей как источник воздействия трифенилфосфата. Environ Int. 2016; 86: 45–51.
CAS
Статья
Google Scholar
Стэплтон Х.М., Клостерхаус С., Келлер А., Фергюсон П.Л., ван Берген С., Купер Е. и др.Идентификация антипиренов в пенополиуретане, собранном из детских товаров. Environ Sci Technol. 2011. 45 (12): 5323–31.
CAS
Статья
Google Scholar
Берковиц Г.С., Ветмур Дж. Г., Бирман-Дейч Э., Обель Дж., Лапински Р. Х., Годболд Дж. Х. и др. Воздействие пестицидов в утробе матери, материнская активность параоксоназы и окружность головы. Перспектива здоровья окружающей среды. 2003. 112 (3): 388–91.
Артикул
Google Scholar
Тан Р., Чен М.Дж., Дин Г.Д., Чен XJ, Хан ХМ, Чжоу К. и др. Связь пренатального воздействия фенолов с исходами родов. Загрязнение окружающей среды. 2013; 178: 115–20.
CAS
Статья
Google Scholar
Ли Б.Э, Пак Х., Хонг Ю.С., Ха М., Ким И, Чанг Н. и др. Пренатальный бисфенол А и исходы родов: исследование MOCEH (Здоровье матери и ребенка). Int J Hyg Environ Health. 2014. 217 (2-3): 328–34.
CAS
Статья
Google Scholar
Филиппат С., Боттон Дж., Калафат А.М., Йе Х, Чарльз М.А., Слама Р. и др. Пренатальное воздействие фенолов и рост у мальчиков. Эпидемиология. 2014; 25 (5): 625–35.
Артикул
Google Scholar
Huo W., Xia W, Wan Y, Zhang B, Zhou A, Zhang Y, et al. Уровни бисфенола A в моче матери и низкая масса тела при рождении: вложенное исследование методом случай-контроль группы Health Baby в Китае. Environ Int. 2015; 85: 96–103.
CAS
Статья
Google Scholar
Guo J, Wu C, Lv S, Lu D, Feng C, Qi X и др. Связь пренатального воздействия пяти хлорфенолов с неблагоприятными исходами родов. Загрязнение окружающей среды. 2016; 214: 478–84.
CAS
Статья
Google Scholar
Lassen TH, Frederiksen H, Kyhl HB, Swan SH, Main KM, Andersson AM, et al. Пренатальное воздействие триклозана и антропометрические меры, включая аногенитальное расстояние у датских младенцев. Перспектива здоровья окружающей среды. 2016; 124 (8): 1261–8.
CAS
Статья
Google Scholar
Ding G, Wang C, Vinturache A, Zhao S, Pan R, Han W, et al. Пренатальное воздействие фенола на низком уровне и исходы родов в Китае. Sci Total Environ. 2017; 607-608: 1400–7.
CAS
Статья
Google Scholar
Etzel TM, Calafat AM, Ye X, Chen A, Lanphear BP, Savitz DA, et al. Концентрация триклозана в моче во время беременности и родов.Environ Res. 2017; 156: 505–11.
CAS
Статья
Google Scholar
Гир Л.А., Пике Б.Ф., Ваксенбаум Дж., Шерер Д.М., Абулафия О., Халден РУ. Связь исходов родов с воздействием парабенов, триклозана и триклокарбана на плод у иммигрантов в Бруклине, Нью-Йорк. J Hazard Mater. 2017; 323 (Pt A): 177–83.
CAS
Статья
Google Scholar
Wu C, Huo W, Li Y, Zhang B, Wan Y, Zheng T и др. Уровни парабенов в моче матери и размер потомства при рождении из китайской когорты. Chemosphere. 2017; 172: 29–36.
CAS
Статья
Google Scholar
Wang X, Wang X, Chen Q, Luo ZC, Zhao S, Wang W и др. Концентрация бисфенола А в моче и гестационный сахарный диабет у китайских женщин. Эпидемиология. 2017; 28 (Приложение 1): S41 – S7.
Артикул
Google Scholar
Ли Ю.М., Хонг Ю.С., Ха М., Ким И., Пак Х., Ким Х.С. и др. Пренатальное воздействие бисфенола-A влияет на рост плода за счет полиморфизма материнской глутатионтрансферазы, а неонатальное воздействие влияет на рост объема ребенка в зависимости от пола: по данным многорегионального проспективного когортного исследования MOCEH. Sci Total Environ. 2018; 612: 1433–41.
CAS
Статья
Google Scholar
Ferguson KK, Meeker JD, Cantonwine DE, Mukherjee B, Pace GG, Weller D, et al.Связь фенола с окружающей средой с ультразвуком и мерами роста плода. Environ Int. 2018; 112: 243–50.
CAS
Статья
Google Scholar
Ferguson KK, Meeker JD, Cantonwine DE, Mukherjee B, Pace GG, Weller D, et al. Исправление к «Связи фенола в окружающей среде с ультразвуком и мерами по доставке плода» [Environment International 112 (2018) 243-250]. Environ Int. 2019; 122: 418.
CAS
Статья
Google Scholar
Hoffman K, Stapleton HM, Lorenzo A, Butt CM, Adair L, Herring AH, et al. Пренатальное воздействие органофосфатов и связь с массой тела при рождении и сроком беременности. Environ Int. 2018; 116: 248–54.
CAS
Статья
Google Scholar
Huo W, Xia W, Wu C, Zhu Y, Zhang B, Wan Y, et al. Уровень триклозана в моче у китайских беременных женщин и его связь с исходами родов. Загрязнение окружающей среды.2018; 233: 872–9.
CAS
Статья
Google Scholar
Краузе М., Фредериксен Х., Сундберг К., Йоргенсен Ф.С., Йенсен Л.Н., Норгаард П. и др. Воздействие УФ-фильтров на мать: ассоциации с гормонами щитовидной железы матери, IGF-I / IGFBP3 и исходами родов. Endocr Connect. 2018; 7 (2): 334–46.
CAS
Статья
Google Scholar
Messerlian C, Mustieles V, Minguez-Alarcon L, Ford JB, Calafat AM, Souter I, et al.Концентрация фенолов в моче до зачатия и во время беременности, а также размер новорожденных, рожденных от матерей и отцов, по данным исследования «Окружающая среда и репродуктивное здоровье» (EARTH). Environ Int. 2018; 114: 60–8.
CAS
Статья
Google Scholar
Оуян Ф., Тан Н., Чжан Х.Дж., Ван Х, Чжао С., Ван В. и др. Уровень триклозана в моче матери, гестационный сахарный диабет и масса тела при рождении у китаянок. Sci Total Environ.2018; 626: 451–7.
CAS
Статья
Google Scholar
Ван И, Хо В., Сюй С, Чжэн Т., Чжан Б., Ли И и др. Взаимосвязь между воздействием бисфенола S на мать и продолжительностью беременности. Загрязнение окружающей среды. 2018; 238: 717–24.
CAS
Статья
Google Scholar
Чжоу В.С., Чен Дж.Л., Линь С.Ф., Чен Ю.С., Ши ФК, Чуанг С.Ю. Биомониторинг концентрации бисфенола А в материнской и пуповинной крови в отношении исходов родов и экспрессии адипокина: когортное исследование новорожденных на Тайване.Здоровье окружающей среды. 2011; 10: 94.
CAS
Статья
Google Scholar
Падманабхан В., Сиферт К., Рэнсом С., Джонсон Т., Пинкертон Дж., Андерсон Л. и др. Уровни бисфенола-А в организме матери при родах: надвигающаяся проблема? J Perinatol. 2008. 28 (4): 258–63.
CAS
Статья
Google Scholar
Троизи Дж., Микельсон С., Ричардс С., Саймс С., Адэр Д., Зулло Ф. и др.Плацентарные концентрации бисфенола А и масса тела при рождении в юго-восточной части плаценты США. 2014; 35 (11): 947–52.
CAS
Статья
Google Scholar
Вейга-Лопес А., Каннан К., Ляо С., Йе В., Домино С.Е., Падманабхан В. Гендерные эффекты на срок беременности и вес при рождении при воздействии бисфенола А на ранних сроках беременности. J Clin Endocrinol Metab. 2015; 100 (11): E1394–403.
CAS
Статья
Google Scholar
Xu X, Chiung YM, Lu F, Qiu S, Ji M, Huo X. Связь совместного воздействия кадмия, бисфенола A и полихлорированного бифенила в утробе матери с экспрессией плацентарных генов и исходами новорожденных. Reprod Toxicol. 2015; 52: 62–70.
CAS
Статья
Google Scholar
Burstyn I., Martin JW, Beesoon S, Bamforth F, Li Q, Yasui Y, et al. Воздействие бисфенола-А на мать и ограничение роста плода: референтное исследование. Int J Environ Res Public Health.2013; 10 (12): 7001–14.
Артикул
CAS
Google Scholar
Pinney SE, Mesaros CA, Snyder NW, Busch CM, Xiao R, Aijaz S и др. Концентрация бисфенола А в околоплодных водах во втором триместре связана со снижением массы тела при рождении у доношенных детей. Reprod Toxicol. 2017; 67: 1–9.
CAS
Статья
Google Scholar
Snijder CA, Heederik D, Pierik FH, Hofman A, Jaddoe VW, Koch HM, et al.Рост плода и пренатальное воздействие бисфенола А: исследование поколения R. Перспектива здоровья окружающей среды. 2013. 121 (3): 393–8.
Артикул
Google Scholar
Hu CY, Li FL, Hua XG, Jiang W, Mao C, Zhang XJ. Связь между пренатальным воздействием бисфенола А и массой тела при рождении: метаанализ. Reprod Toxicol. 2018; 79: 21–31.
CAS
Статья
Google Scholar
Этвуд Д., Пейсли-Джонс К. Продажи и использование в пестицидной промышленности: рыночные оценки на 2008-2012 гг. Вашингтон, округ Колумбия: Агентство по охране окружающей среды США; 2017.
Google Scholar
Грубе А., Дональдсон Д., Кили Т., Ву Л. Продажи и использование пестицидов в промышленности: рыночные оценки 2006 и 2007 годов. Вашингтон, округ Колумбия: Агентство по охране окружающей среды США; 2011.
Google Scholar
CDC. Резюме биомониторинга Фосфорорганические инсектициды: Метаболиты диалкилфосфата: Центры по контролю заболеваний; 2016 [обновлено 23.12.2016. Доступно по адресу: https://www.cdc.gov/biomonitoring/op-dpm_biomonitoringsummary.html.
Судакин Д.Л., Каменный Д.Л. Диалкилфосфаты как биомаркеры органофосфатов: нынешний разрыв между эпидемиологией и клинической токсикологией. Clin Toxicol (Phila). 2011; 49 (9): 771–81.
CAS
Статья
Google Scholar
Клун А.Л., Райан ПБ, Барр Д.Б. Были ли эффективными меры регулирования по сокращению воздействия фосфорорганических инсектицидов? Перспектива здоровья окружающей среды. 2012; 120 (4): 521–5.
CAS
Статья
Google Scholar
Wolff MS, Engel S, Berkowitz G, Teitelbaum S, Siskind J, Barr DB, et al. Пренатальное воздействие пестицидов и ПХБ и исходы родов. Pediatr Res. 2007. 61 (2): 243–50.
CAS
Статья
Google Scholar
Chevrier C, Limon G, Monfort C, Rouget F, Garlantezec R, Petit C и др. Мочевые биомаркеры пренатального воздействия атразина и неблагоприятных исходов родов в когорте новорожденных PELAGIE. Перспектива здоровья окружающей среды. 2011; 119 (7): 1034–41.
CAS
Статья
Google Scholar
Эскенази Б., Харли К., Брэдман А., Велтциен Э., Джуэлл Н. П., Барр Д. Б. и др. Ассоциация внутриутробного воздействия фосфорорганических пестицидов и роста плода и продолжительности беременности в сельскохозяйственном населении.Перспектива здоровья окружающей среды. 2004. 112 (10): 1116–24.
CAS
Статья
Google Scholar
Harley KG, Huen K, Aguilar Schall R, Holland NT, Bradman A, Barr DB, et al. Связь воздействия фосфорорганических пестицидов и параоксоназы с исходами родов у американок мексиканского происхождения. PLoS One. 2011; 6 (8): e23923.
CAS
Статья
Google Scholar
Раух С.А., Браун Дж. М., Барр Д. Б., Калафат А. М., Хури Дж., Монтесано А. М. и др.Связь пренатального воздействия метаболитов фосфорорганических пестицидов с гестационным возрастом и массой тела при рождении. Перспектива здоровья окружающей среды. 2012; 120 (7): 1055–60.
CAS
Статья
Google Scholar
Ван П, Тиан Й, Ван XJ, Гао Й, Ши Р., Ван GQ и др. Воздействие фосфорорганических пестицидов и перинатальные исходы в Шанхае, Китай. Environ Int. 2012; 42: 100–4.
CAS
Статья
Google Scholar
Чжан Дж., Йошинага Дж., Хисада А., Шираиши Х., Шимодаира К., Окаи Т. и др. Пренатальное воздействие инсектицидов пиретроид, уровни гормонов щитовидной железы и размеры новорожденных при рождении. Sci Total Environ. 2014; 488-489: 275–9.
CAS
Статья
Google Scholar
Дин Дж., Цуй С., Чен Л., Гао И, Чжоу Ю., Ши Р. и др. Пренатальное воздействие инсектицидов-пиретроидов и исходы родов в сельских районах Северного Китая. J Expo Sci Environ Epidemiol.2015; 25 (3): 264–70.
CAS
Статья
Google Scholar
Naksen W, Prapamontol T, Mangklabruks A, Chantara S, Thavornyutikarn P, Srinual N, et al. Связь воздействия фосфорорганических пестицидов на мать и активности PON1 с исходами родов в когорте детей SAWASDEE, Таиланд. Environ Res. 2015; 142: 288–96.
CAS
Статья
Google Scholar
Харлей К.Г., Энгель С.М., Ведар М.Г., Эскенази Б., Уайатт Р.М., Lanphear BP и др. Пренатальное воздействие фосфорорганических пестицидов и рост плода: объединенные результаты четырех когортных исследований продольных рождений. Перспектива здоровья окружающей среды. 2016; 124 (7): 1084–92.
CAS
Статья
Google Scholar
Лю П., Ву Ц., Чанг Х, Ци Х, Чжэн М., Чжоу З. Неблагоприятные связи пренатального и послеродового воздействия фосфорорганических пестицидов с развитием нервной системы младенцев в сельскохозяйственной зоне провинции Цзянсу, Китай.Перспектива здоровья окружающей среды. 2016; 124 (10): 1637–43.
CAS
Статья
Google Scholar
Dalsager L, Christensen LE, Kongsholm MG, Kyhl HB, Nielsen F, Schoeters G, et al. Связь воздействия на мать фосфорорганических и пиретроидных инсектицидов и гербицида 2,4-D с исходами родов и аногенитальной дистанцией через 3 месяца в детской когорте Оденсе. Reprod Toxicol. 2018; 76: 53–62.
CAS
Статья
Google Scholar
Parvez S, Gerona RR, Proctor C, Friesen M, Ashby JL, Reiter JL и др. Воздействие глифосата во время беременности и сокращение срока беременности: проспективное когортное исследование в Индиане. Здоровье окружающей среды. 2018; 17 (1): 23.
CAS
Статья
Google Scholar
Чжан Дж, Го Дж, Лу Д, Ци Х, Чанг Х, Ву Ц и др. Уровни карбофуранфенола в моче матери до родов и исходы родов в когорте родившихся в Шеяне. Sci Total Environ.2018; 625: 1667–72.
CAS
Статья
Google Scholar
Коста Л.Г., Рихтер Р.Дж., Ли В.Ф., Коул Т., Гиззетти М., Ферлонг СЕ. Параоксоназа (ПОН 1) как биомаркер предрасположенности к токсичности фосфорорганических соединений. Биомаркеры. 2003. 8 (1): 1–12.
CAS
Статья
Google Scholar
Барр Д. Б., Анант К. В., Ян Х, Лэшли С., Смулиан Дж. К., Леду Т. А. и др. Концентрации пестицидов в сыворотке крови матери и пуповины и их связь с исходами родов в популяции беременных женщин и новорожденных в Нью-Джерси.Sci Total Environ. 2010. 408 (4): 790–5.
CAS
Статья
Google Scholar
Нета Дж., Голдман Л. Р., Барр Д., Апельберг Б. Дж., Виттер Ф. Р., Халден РУ. Воздействие на плод смесей хлордана и перметрина в отношении воспалительных цитокинов и исходов родов. Environ Sci Technol. 2011; 45 (4): 1680–7.
CAS
Статья
Google Scholar
Уайатт Р.М., Каманн Д., Перера Ф.П., Раух В.А., Танг Д., Кинни П.Л. и др.Биомаркеры при оценке воздействия инсектицидов в жилых помещениях во время беременности и их влияния на рост плода. Toxicol Appl Pharmacol. 2005. 206 (2): 246–54.
CAS
Статья
Google Scholar
Уайатт Р.М., Раух В., Барр Д.Б., Каманн Д.Э., Эндрюс Х.Ф., Гарфинкель Р. и др. Пренатальное воздействие инсектицидов, масса тела и длина тела при рождении среди городского меньшинства. Перспектива здоровья окружающей среды. 2004. 112 (10): 1125–32.
CAS
Статья
Google Scholar
Wickerham EL, Lozoff B, Shao J, Kaciroti N, Xia Y, Meeker JD. Пониженная масса тела при рождении по сравнению с пестицидными смесями, обнаруженными в пуповинной крови доношенных детей. Environ Int. 2012; 47: 80–5.
CAS
Статья
Google Scholar
Кутроулакис Д., Сифакис С., Цацаракис М.Н., Алегакис А.К., Теодоропулу Э., Каввалакис М.П. и др. Диалкилфосфаты в околоплодных водах как биомаркер воздействия органофосфатов на плод на Крите, Греция; связь с ростом плода.Reprod Toxicol. 2014; 46: 98–105.
CAS
Статья
Google Scholar
Koch HM, Aylward LL, Hays SM, Smolders R, Moos RK, Cocker J, et al. Межиндивидуальные и внутрииндивидуальные вариации концентраций биомаркеров в моче в течение 6-дневного периода отбора проб. Часть 2: ингредиенты средств личной гигиены. Toxicol Lett. 2014; 231 (2): 261–9.
CAS
Статья
Google Scholar
Ye X, Wong LY, Bishop AM, Calafat AM. Вариабельность концентраций бисфенола А в моче в точечных пробах, первых утренних мочеиспусканиях и 24-часовых сборах. Перспектива здоровья окружающей среды. 2011. 119 (7): 983–8.
CAS
Статья
Google Scholar
Фишер М., Арбакл Т.Э., Маллик Р., Леблан А., Хаузер Р., Фили М. и др. Концентрация бисфенола А и метаболитов фталата в моче: суточная и вариабельность во время беременности. J Expo Sci Environ Epidemiol.2015; 25 (3): 231–9.
CAS
Статья
Google Scholar
Шин Х.М., Беннетт Д.Х., Баркоски Дж., Йе Х, Калафат А.М., Танкреди Д. и др. Вариабельность концентраций метаболитов фталата в моче во время беременности в первых утренних мочеиспусканиях и объединенных образцах. Environ Int. 2019; 122: 222–30.
CAS
Статья
Google Scholar
Preau JL Jr, Wong LY, Silva MJ, Needham LL, Calafat AM.Изменчивость в течение 1 недели концентраций метаболитов диэтилфталата и ди (2-этилгексил) фталата в моче среди восьми взрослых: обсервационное исследование. Перспектива здоровья окружающей среды. 2010. 118 (12): 1748–54.
CAS
Статья
Google Scholar
Perrier F, Giorgis-Allemand L, Slama R, Philippat C. Объединение биологических образцов внутри субъекта для уменьшения ошибочной классификации воздействия в исследованиях на основе биомаркеров. Эпидемиология.2016; 27 (3): 378–88.
Артикул
Google Scholar
Vernet C, Philippat C, Calafat AM, Ye X, Lyon-Caen S, Siroux V, et al. Внутри-дневная, междневная и межнедельная изменчивость концентраций фенольных биомаркеров в моче у беременных женщин. Перспектива здоровья окружающей среды. 2018; 126 (3): 037005.
Артикул
Google Scholar
Брэдман А., Когут К., Эйзен Е.А., Джуэлл Н.П., Кирос-Алкала Л., Касторина Р. и др.Вариабельность уровней фосфорорганических метаболитов пестицидов в точечных и суточных пробах мочи, собранных у детей младшего возраста в течение 1 недели. Перспектива здоровья окружающей среды. 2013. 121 (1): 118–24.
Артикул
Google Scholar
Kissel JC, Curl CL, Kedan G, Lu C, Griffith W., Barr DB, et al. Сравнение уровней метаболитов фосфорорганических пестицидов в однократных и многократных пробах мочи, взятых у детей дошкольного возраста в штате Вашингтон.J Expo Anal Environ Epidemiol. 2005. 15 (2): 164–71.
CAS
Статья
Google Scholar
Teitelbaum SL, Li Q, Lambertini L., Belpoggi F, Manservisi F, Falcioni L, et al. Парные концентрации биомаркеров диэтилфталата, метилпарабена и триклозана в сыворотке и моче у крыс. Перспектива здоровья окружающей среды. 2016; 124 (1): 39–45.
CAS
Статья
Google Scholar
Вайс Л., Арбакл Т.Э., Фишер М., Рамзи Т., Маллик Р., Хаузер Р. и др. Временная изменчивость и источники воздействия триклозана во время беременности. Int J Hyg Environ Health. 2015; 218 (6): 507–13.
CAS
Статья
Google Scholar
Романо М.Э., Каллоо Г., Этцель Т., Браун Дж. М.. Касательно: сезонные колебания воздействия химических веществ, нарушающих работу эндокринной системы. Эпидемиология. 2017; 28 (5): e42 – e3.
Артикул
Google Scholar
Loraine GA, Pettigrove ME. Сезонные колебания концентраций фармацевтических препаратов и средств личной гигиены в питьевой воде и очищенных сточных водах в южной Калифорнии. Environ Sci Technol. 2006. 40 (3): 687–95.
CAS
Статья
Google Scholar
Smith MN, Workman T, McDonald KM, Vredevoogd MA, Vigoren EM, Griffith WC, et al. Сезонные и профессиональные тенденции содержания пяти фосфорорганических пестицидов в домашней пыли.J Expo Sci Environ Epidemiol. 2017; 27 (4): 372–8.
CAS
Статья
Google Scholar
Дженсен С.Б., Гамборг М., Раймонд К., МакГрат Дж., Соренсен Т.И., Хейтманн Б.Л. Вековые тенденции сезонных колебаний веса при рождении. Early Hum Dev. 2015; 91 (6): 361–5.
Артикул
Google Scholar
McGrath JJ, Keeping D, Saha S, Chant DC, Lieberman DE, O’Callaghan MJ.Сезонные колебания массы тела при рождении и длины конечностей новорожденного; влияет ли пренатальный витамин D на размер и форму новорожденного? Early Hum Dev. 2005. 81 (7): 609–18.
CAS
Статья
Google Scholar
Мюррей Л.Дж., О’Рейли Д.П., Беттс Н., Паттерсон С.К., Дэйви Смит Дж., Эванс А.Е. Сезон и температура наружного воздуха: влияние на массу тела при рождении. Obstet Gynecol. 2000. 96 (5 Pt 1): 689–95.
CAS
Google Scholar
Гренландия S, Перл Дж., Робинс Дж. М.. Причинно-следственные диаграммы для эпидемиологического исследования. Эпидемиология. 1999. 10 (1): 37–48.
CAS
Статья
Google Scholar
Врачи-акушеры, гинекологи. Бюллетень практики ACOG No. 134: ограничение роста плода. Obstet Gynecol. 2013; 121 (5): 1122.
Артикул
Google Scholar
GMB L, Grewal J, Albert PS, Sciscione A, Wing DA, Grobman WA, et al.Расовые / этнические стандарты роста плода: исследования роста плода NICHD. Am J Obstet Gynecol. 2015; 213 (4): 449. e1 – e41.
Артикул
Google Scholar
Гардози Дж., Чанг А., Калян Б., Сахота Д., Симондс Э.М. Индивидуальные карты дородового роста. Ланцет. 1992. 339 (8788): 283–7.
CAS
Статья
Google Scholar
Cantonwine DE, Ferguson KK, Mukherjee B., Chen YH, Smith NA, Robinson JN, et al.Использование продольных показателей роста плода для создания стандартного метода оценки воздействия материнских заболеваний и воздействия окружающей среды. PLoS One. 2016; 11 (1): e0146532.
Артикул
CAS
Google Scholar
Gaillard R, de Ridder MA, Verburg BO, Witteman JC, Mackenbach JP, Moll HA, et al. Индивидуально настроенные диаграммы веса плода, полученные на основе ультразвуковых измерений: исследование поколения R. Eur J Epidemiol.2011; 26 (12): 919–26.
Артикул
Google Scholar
Verburg BO, Steegers EA, De Ridder M, Snijders RJ, Smith E, Hofman A, et al. Новые диаграммы для ультразвукового датирования беременности и оценки роста плода: продольные данные популяционного когортного исследования. Ультразвуковой акушерский гинекол. 2008. 31 (4): 388–96.
CAS
Статья
Google Scholar
Гардози Дж., Фрэнсис А., Тернер С., Уильямс М. Индивидуальные диаграммы роста: обоснование, проверка и клинические преимущества. Am J Obstet Gynecol. 2018; 218 (2S): S609 – S18.
Артикул
Google Scholar
Папагеоргиу А.Т., Кеннеди С.Х., Саломон Л.Дж., Альтман Д.Г., Охума Е.О., Стоунз В. и др. Стандарты роста плода INTERGROWTH-21 (st): к глобальной интеграции беременных и педиатрической помощи. Am J Obstet Gynecol. 2018; 218 (2S): S630 – S40.
Артикул
Google Scholar
Esakoff TF, Cheng YW, Sparks TN, Caughey AB. Связь между массой тела при рождении 4000 г или более и перинатальными исходами у пациентов с гестационным сахарным диабетом и без него. Am J Obstet Gynecol. 2009; 200 (6): 672 e1–4.
Артикул
Google Scholar
Stotland NE, Caughey AB, Breed EM, Escobar GJ. Факторы риска и акушерские осложнения, связанные с макросомией.Int J Gynaecol Obstet. 2004. 87 (3): 220–6.
CAS
Статья
Google Scholar
Kajantie E, Osmond C, Barker DJ, Forsen T, Phillips DI, Eriksson JG. Размер при рождении как предиктор смертности в зрелом возрасте: период наблюдения 350 000 человеко-лет. Int J Epidemiol. 2005. 34 (3): 655–63.
Артикул
Google Scholar
Гренландия S. Дозо-реакция и анализ тенденций в эпидемиологии: альтернативы категориальному анализу.Эпидемиология. 1995. 6 (4): 356–65.
CAS
Статья
Google Scholar
Weinberg CR. Насколько плоха категоризация? Эпидемиология. 1995. 6 (4): 345–7.
CAS
Статья
Google Scholar
Чен Ю.Х., Фергюсон К.К., Микер Д.Д., МакЭлрат Т.Ф., Мукерджи Б. Статистические методы моделирования повторных измерений биомаркеров воздействия окружающей среды на мать во время беременности в связи с преждевременными родами.Здоровье окружающей среды. 2015; 14: 9.
Артикул
CAS
Google Scholar
Бакли Дж. П., Хамра, Великобритания, Браун Дж. М.. Статистические подходы к исследованию периодов восприимчивости в исследованиях гигиены окружающей среды детей. Curr Environ Health Rep., 2019; 6 (1): 1–7.
Артикул
Google Scholar
Ferguson KK, McElrath TF, Meeker JD. Воздействие фталатов в окружающей среде и преждевременные роды.JAMA Pediatr. 2014. 168 (1): 61–7.
Артикул
Google Scholar
Cantonwine D, Meeker JD, Hu H, Sanchez BN, Lamadrid-Figueroa H, Mercado-Garcia A, et al. Воздействие бисфенола в Мехико и риск недоношенности: пилотное исследование методом случай-контроль. Здоровье окружающей среды. 2010; 9: 62.
Артикул
CAS
Google Scholar
Behnia F, Peltier M, Getahun D, Watson C, Saade G, Menon R.Высокая концентрация бисфенола А (BPA) в компартменте матери, но не плода, увеличивает риск спонтанных преждевременных родов. J Matern Fetal Neonatal Med. 2016; 29 (22): 3583–9.
CAS
Статья
Google Scholar
Weinberger B, Vetrano AM, Archer FE, Marcella SW, Buckley B, Wartenberg D, et al. Влияние воздействия фталатов и бисфенола A на мать во время беременности на срок гестации. J Matern Fetal Neonatal Med.2014. 27 (4): 323–7.
CAS
Статья
Google Scholar
Коул С.Р., Эрнан Массачусетс. Ошибки в оценке прямых эффектов. Int J Epidemiol. 2002. 31 (1): 163–5.
Артикул
Google Scholar
Whitcomb BW, Schisterman EF, Louis GM. Гестационный возраст и срок беременности: причина, следствие или временные рамки? Hum Reprod. 2007; 22 (12): 3267.
Артикул
Google Scholar
Geens T, Aerts D, Berthot C, Bourguignon JP, Goeyens L, Lecomte P и др. Обзор диетического и недиетического воздействия бисфенола-А. Food Chem Toxicol. 2012. 50 (10): 3725–40.
CAS
Статья
Google Scholar
Зулиняк М.А., де Соуза Р.Дж., Шейх М., Десаи Д., Лефевр Д.Л., Гупта М. и др. Отличается ли влияние растительной диеты во время беременности на массу тела при рождении в зависимости от этнической принадлежности? Анализ диеты из предполагаемого канадского альянса когорт.BMJ Open. 2017; 7 (11): e017753.
Артикул
Google Scholar
Кнудсен В.К., Орозова-Беккевольд И.М., Миккельсен ТБ, Вольф С., Ольсен С.Ф. Основные особенности питания во время беременности и развития плода. Eur J Clin Nutr. 2008. 62 (4): 463–70.
CAS
Статья
Google Scholar
Лю Дж., Ваттар Н., Филд С.Дж., Дину И., Дьюи Д., Мартин Дж. У. и др. Воздействие и пищевые источники бисфенола A (BPA) и альтернатив BPA среди матерей в когортном исследовании APrON.Environ Int. 2018; 119: 319–26.
CAS
Статья
Google Scholar
Браун Дж. М., Калькбреннер А. Э., Калафат А. М., Бернерт Дж. Т., Йе Х, Сильва М. Дж. И др. Вариабельность и предикторы концентрации бисфенола А в моче во время беременности. Перспектива здоровья окружающей среды. 2011; 119 (1): 131–7.
CAS
Статья
Google Scholar
Касас М., Валви Д., Луке Н., Бальестерос-Гомес А., Карсин А. Э., Фернандес М. Ф. и др.Диетические и социально-демографические детерминанты концентрации бисфенола А в моче у беременных женщин и детей. Environ Int. 2013; 56: 10–8.
CAS
Статья
Google Scholar
Ляо С., Каннан К. Концентрации и профили бисфенола А и других аналогов бисфенола в пищевых продуктах из США и их влияние на воздействие на человека. J. Agric Food Chem. 2013. 61 (19): 4655–62.
CAS
Статья
Google Scholar
Серрано С.Е., Браун Дж., Трасанде Л., Диллс Р., Сатьянараяна С. Фталаты и диета: обзор данных мониторинга пищевых продуктов и эпидемиологии. Здоровье окружающей среды. 2014; 13 (1): 43.
Артикул
CAS
Google Scholar
Стинсон С. Половые различия в чувствительности окружающей среды во время роста и развития. Am J Phys Anthropol. 1985. 28 (S6): 123–47.
Артикул
Google Scholar
Schwarzler P, Bland JM, Holden D, Campbell S, Ville Y. Антенатальные справочные таблицы роста с учетом пола для неосложненных одноплодных беременностей на 15-40 неделе беременности. Ультразвуковой акушерский гинекол. 2004. 23 (1): 23–9.
CAS
Статья
Google Scholar
Уокер Н., Филис П., Соффентини У., Беллингхэм М., О’Шонесси П.Дж., Фаулер, Пенсильвания. Локализация и выражение плацентарного переносчика у человека: важность различий между видами, полом и гестационным возрастом.Биол Репрод. 2017; 96 (4): 733–42.
Артикул
Google Scholar
Клифтон VL. Обзор: Секс и плацента человека: опосредующие дифференциальные стратегии роста и выживания плода. Плацента. 2010; 31 (Прил.): S33–9.
Артикул
CAS
Google Scholar
Бакли Дж. П., Доэрти Б. Т., Кейл А. П., Энгель С. М.. Статистические подходы к оценке половых эффектов в исследованиях эндокринных разрушителей.Перспектива здоровья окружающей среды. 2017; 125 (6): 067013.
Артикул
Google Scholar
Вудрафф Т.Дж., Зота А.Р., Шварц Дж.М. Химические вещества окружающей среды у беременных женщин в США: NHANES 2003-2004. Перспектива здоровья окружающей среды. 2011. 119 (6): 878–85.
Артикул
Google Scholar
Mitro SD, Johnson T, Zota AR. Кумулятивное воздействие химических веществ во время беременности и раннего развития.Curr Environ Health Rep. 2015; 2 (4): 367–78.
CAS
Статья
Google Scholar
Браун Дж. М., Геннингс К., Хаузер Р., Вебстер Т.Ф. Что эпидемиологические исследования могут сказать нам о влиянии химических смесей на здоровье человека? Перспектива здоровья окружающей среды. 2016; 124 (1): A6–9.
Артикул
Google Scholar
Клаус Хенн Б., Коул Б.А., Райт РО. Химические смеси и здоровье детей.Curr Opin Pediatr. 2014; 26 (2): 223–9.
CAS
Статья
Google Scholar
Тейлор К.В., Жубер Б.Р., Браун Дж. М., Дилворт С., Геннингс К., Хаузер Р. и др. Статистические подходы к оценке воздействия на здоровье химических смесей в окружающей среде в эпидемиологии: уроки инновационного семинара. Перспектива здоровья окружающей среды. 2016; 124 (12): A227 – A9.
Артикул
Google Scholar
Liew Z, Olsen J, Cui X, Ritz B, Arah OA. Предвзятость из-за обусловленности живорождений в когортах беременных: иллюстрация, основанная на развитии нервной системы у детей после пренатального воздействия органических загрязнителей. Int J Epidemiol. 2015; 44 (1): 345–54.
Артикул
Google Scholar
Эрнан М.А., Эрнандес-Диас С., Робинс Дж. М.. Структурный подход к смещению отбора. Эпидемиология. 2004. 15 (5): 615–25.
Артикул
Google Scholar
Zota AR, Singla V, Adamkiewicz G, Mitro SD, Dodson RE. Снижение воздействия химических веществ дома: возможности для действий. J Epidemiol Community Health. 2017.
Границы | Стероиды, Беременность и развитие плода
Введение
Чтобы поддержать беременность у млекопитающих, необходимо внести множество изменений в физиологию матери. Например, материнские иммунные ответы жестко регулируются для предотвращения воспалительных реакций и отторжения аллоантигенов, экспрессируемых в тканях плода (1, 2).Иммунная адаптация матери к беременности в основном модулируется эндокринными сигналами. Эти сигналы включают выраженный рост половых гормонов, таких как прогестерон и эстрадиол. Прогестерон необходим для установления и продолжения беременности (3). Прогестерон не только выполняет несколько иммуномодулирующих функций (4), но также поддерживает восприимчивость и покой матки (3, 5). В дополнение к половым стероидам, материнские глюкокортикоиды резко увеличиваются в течение беременности, чтобы удовлетворить растущие потребности в энергии (6).Глюкокортикоиды являются мощными активаторами GR, и эта активация оказывает плейотропное действие на иммунные клетки (7, 8). Однако молекулярные механизмы, лежащие в основе того, как глюкокортикоиды вносят вклад в иммунную адаптацию матери к беременности и взаимодействие между глюкокортикоидами и половыми гормонами, такими как прогестерон, остаются в значительной степени неясными.
Интересно, что хотя общепризнано, что прогестерон способствует развитию материнской иммунной толерантности к аллоантигенам, происходящим из концепта, рецепторы прогестерона не экспрессируются повсеместно на иммунных клетках (9).Эта загадка была пролита светом совсем недавно, когда было выявлено, что ключевые особенности индуцированной прогестероном материнской иммунной адаптации к беременности опосредуются через рецептор глюкокортикоидов (9, 10). Таким образом, в настоящей обзорной рукописи мы стремимся пересмотреть текущие данные о синтезе и взаимодействии глюкокортикоидов и прогестерона во время беременности, их влиянии на иммунную систему и последствиях для поддержания беременности и развития плода.
Синтез, регуляция и рецепторы прогестерона и глюкокортикоидов во время беременности
Рецепторы прогестерона и глюкокортикоидов в иммунных клетках
И прогестерон, и глюкокортикоиды в значительной степени участвуют в регуляции иммунных ответов (4, 7, 11).Структурное сходство между глюкокортикоидами и прогестероном поднимает интригующую концепцию взаимных, взаимосвязанных, а также индивидуальных путей, вызываемых этими гормонами. Эта концепция становится актуальной в контексте беременности, когда нарушение равновесия между этими стероидами связано с измененными иммунными реакциями матери и патологическими исходами беременности (2, 7).
Геномные эффекты прогестерона и глюкокортикоидов опосредуются внутриклеточными рецепторами прогестерона и глюкокортикоидов (PR и GR), которые принадлежат к подсемейству надсемейства ядерных рецепторов (4, 7, 12).При связывании с лигандами PR и GR перемещаются в ядра клеток, где они взаимодействуют со специфическими участками ДНК, чтобы действовать как факторы транскрипции, которые модулируют экспрессию генов (7, 11, 12). Несмотря на высокую аминокислотную идентичность PR и GR (12), их сродство к связыванию стероидов, паттерны экспрессии и гены-мишени заметно различаются, как показано в Таблице 1.
Таблица 1 . Сравнение общих характеристик рецепторов прогестерона и глюкокортикоидов.
Ген Nr3c1, кодирующий GR, экспрессируется в большинстве тканей организма и практически во всех клетках иммунной системы (31, 32). Глюкокортикоиды могут связывать GR с высокой аффинностью, вызывая геномные, но также негеномные пути в иммунных клетках (7, 33). Важно отметить, что беспорядочное связывание прогестерона с GR также наблюдалось в ряде случаев, особенно в моделях in vitro (9, 14). Благодаря альтернативному сплайсингу и альтернативным сайтам инициации трансляции описано множество изоформ GR (7, 13).Эти изоформы также присутствуют в иммунных клетках и связаны с разнообразной трансляционной активностью или связыванием с глюкокортикоидами (7, 34). Тем не менее, остается неизвестным, влияют ли изоформы GR во время беременности или имеют ли они дифференциальное сродство к прогестерону. Действительно, как подробно показано в Таблице 1, большинство прогестагенов имеют лишь очень ограниченное сродство к глюкокортикоидным рецепторам по сравнению с глюкокортикоидами (14–16, 34).
Ген Nr3c3 кодирует две изоформы PR, PRA и PRB (35). Обе изоформы PR обладают различной транскрипционной активностью и преимущественно обнаруживаются в молочной железе и в женских репродуктивных тканях, таких как яичник и матка (23, 35).В целом, наличие PR в иммунных клетках вызывает разногласия. Хотя прямое влияние прогестерона, например, на Т-клетки во время беременности, предлагалось давно (36–39), недавние результаты, основанные на подходах ОТ-кПЦР, нацеленных на обнаружение PR на отдельных подмножествах иммунных клеток, не подтвердили экспрессию PR, например, в Т- и NK-клетки (9, 20, 40, 41). Сообщалось о беспорядочном связывании PR глюкокортикоидами, хотя нет единого мнения относительно сообщаемых относительных аффинностей связывания по сравнению с прогестероном (14, 15).
Помимо PR, прогестерон может вызывать негеномные действия путем связывания с сопряженными с G-белком мембранными рецепторами прогестина (мембранные рецепторы прогестерона: mPR) и так называемыми мембранными компонентами рецепторов прогестерона (PGRMC) [обзор в (4)]. Среди них mPRalpha / PAQR7 и mPRbeta / PAQR8, а также PGRCM1 и 2 присутствуют в Т-клетках (20, 29), а mPRalpha экспрессируется в определенных фракциях циркулирующих Treg (42). Следовательно, эти пути могут объяснить некоторые эффекты прогестерона на иммунные клетки.Следует отметить, что информация о связывании глюкокортикоидов с mPR неоднозначна [(18), таблица 1), в то время как связывание глюкокортикоидов с PGRMC описано, хотя и с низким сродством (19).
Взятые вместе, близкое структурное сходство и ограниченная клетками экспрессия рецепторов, прогестерон и глюкокортикоиды могут действовать на иммунные клетки через негеномные пути, а также, вероятно, связываясь с GR, а не с PR. Из-за их высокого уровня во время беременности кажется вероятным, что и прогестерон, и глюкокортикоиды действуют на GR, вызывая иммунорегуляторные сигналы.Это будет зависеть от биодоступности стероидов, которая изменяется во время беременности в зависимости от их синтеза, количества белков-носителей, ограничивающих поступление свободных стероидов в ткани, а также от метаболизма или исключения этих стероидов из клеток-мишеней.
Биодоступность прогестерона и глюкокортикоидов во время беременности
Синтез стероидов, например, в случае прогестерона и глюкокортикоидов, заключается в превращении холестерина в качестве субстрата через ряд ферментативных реакций с образованием структурно взаимосвязанных продуктов.Этот процесс строго регулируется тканевой и клеточной экспрессией стероидогенных ферментов (43).
Например, после овуляции фолликулярные клетки яичников, которые поддерживают созревание ооцита, подвергаются так называемому процессу лютеинизации с образованием желтого тела. Во время лютеинизации значительно усиливается экспрессия генов и белков, которые опосредуют синтез прогестерона (44). У мышей и других млекопитающих на желтое тело в значительной степени приходится значительный синтез прогестерона de novo на протяжении всей беременности.Здесь концентрация прогестерона в крови увеличивается до середины или поздних сроков беременности, когда она постепенно начинает снижаться (45). Этот дефицит прогестерона считается предшествующим событием, запускающим роды у мышей (46). У людей плацента экспрессирует ферменты, участвующие в выработке прогестерона, и начинает стероидогенный синтез на 7–9 неделях беременности, после начального синтеза прогестерона яичниками (47). Уровень прогестерона постоянно повышается, пока не достигнет плато на последних неделях беременности (48).Снижение прогестерона на поздних сроках беременности не происходит у людей, и было высказано предположение, что роды являются результатом функционального дефицита прогестерона, возникающего в миометрии и других тканях матки (4, 49). Здесь дифференциальная экспрессия изоформ рецепторов прогестерона может способствовать индуцированной прогестероном релаксации шейки матки во время родов (49), тем самым способствуя доставке плода человека (50, 51).
Хорошо известно, что глюкокортикоиды в основном вырабатываются в коре надпочечников, где они проявляют циркадные и ультрадианные ритмы (4).Уровень глюкокортикоидов у матери резко повышается во время беременности, например, на поздних сроках беременности у мышей концентрация глюкокортикоидов увеличивается примерно в 20 раз по сравнению с концентрацией в середине беременности (6). У людей кортизол, основной глюкокортикоид, также резко увеличивается во время беременности, достигая ~ 350 нг / мл сыворотки на 26 неделе беременности (52). После этого уровень кортизола остается относительно стабильным до родов, когда он сильно повышается (52). У женщин плацентой вырабатывается кортикотропин-рилизинг-гормон (CRH), чтобы дополнительно стимулировать выработку глюкокортикоидов надпочечниками (53), что указывает на критическую важность синтеза глюкокортикоидов во время беременности.
Действие этих высоких уровней прогестерона и глюкокортикоидов ограничивается их связыванием с белками-носителями плазмы (54). Считается, что только «свободные» фракции прогестерона и глюкокортикоидов способны связывать рецепторы для выполнения биологических функций, например, после диффузии внутри клеток-мишеней (54). Глобулин, связывающий кортикостероиды (CBG), транспортирует около 75–80% глюкокортикоидов плазмы, тем самым критически ограничивая количество свободных глюкокортикоидов, доступных клеткам (55).Несмотря на выраженное повышение уровня CBG и связывающей способности на протяжении всей беременности (6), 5–6% общего кортизола остается свободным (56). Следовательно, абсолютная концентрация свободных глюкокортикоидов увеличивается во время беременности (56). Напротив, как фракция свободного прогестерона, так и его общая концентрация увеличиваются на протяжении всей беременности (57). Прогестерон только частично связывает CBG с сродством в четыре раза меньшим, чем глюкокортикоиды. Вместо этого примерно 80% прогестерона плазмы в первую очередь связывает альбумин (54).
Доступность стероидных гормонов может быть дополнительно снижена за счет их внутриклеточного метаболизма. Однако физиологическая экспрессия 11β-гидроксистероиддегидрогеназы 2 типа, способной метаболизировать глюкокортикоиды в неактивные формы (6), в значительной степени незначительна в иммунных клетках человека или мыши (58), и потенциальная модуляция во время беременности до сих пор остается неизученной. Более того, было показано, что метаболизирующий прогестерон фермент 20α-гидроксистероиддегидрогеназа (Akr1c18) высоко экспрессируется в тимоцитах и первоначально рассматривался как маркер для зрелых Т-клеток (59, 60).Однако данные, доступные на сегодняшний день, кажутся неоднозначными, поскольку Akr1c18 не указан при поиске в базе данных экспрессии генов для иммунных клеток (32). Следовательно, значение или роль экспрессии 20α-HSD или 11β-HSD в лимфоцитах и, возможно, также в миелоидных клетках, все еще неизвестны.
Более того, переносчики оттока Abcb1a и Abcc1, члены семейства трансмембранных переносчиков АТФ-связывающей кассеты (ABC), могут активно исключать внутриклеточные глюкокортикоиды, тем самым ограничивая их активность, например, в плаценте мыши (6).Abcb1a и Abcc1 (также известные как Mdr1 и Mrp1) по-разному экспрессируются в иммунных клетках, таких как Т-лимфоциты (61), и дефицит Abcb1a был связан с уменьшением генерации Tregs in vivo и in vitro на моделях мышей (62). Примечательно, что прогестерон и другие прогестагены являются мощными ингибиторами функции Abcb1a (63), механизма, который может действовать синергетически с высокими уровнями глюкокортикоидов, дополнительно усиливая действие глюкокортикоидов во время беременности.
Взятые вместе существующие опубликованные данные об уровнях прогестерона и глюкокортикоидов, а также об их связывании с белками плазмы во время беременности человека, становится очевидным, что ранняя беременность состоит из периода высокого прогестерона и низкой доступности глюкокортикоидов.Напротив, уровень свободного прогестерона и глюкокортикоидов увеличивается на протяжении всей беременности и обнаруживается в сопоставимых диапазонах концентраций на поздних сроках беременности (48, 57). Следовательно, хотя большое количество доказательств подтверждает, что иммуномодуляция, управляемая стероидами, в основном зависит от прогестерона в начале беременности, есть соблазн предположить, что на более поздних стадиях глюкокортикоиды с высоким сродством к GR приобретают значение для поддержания материнской иммунной толерантности. В этом контексте регуляция биодоступности прогестерона и глюкокортикоидов посредством экспрессии специфических метаболизирующих ферментов и транспортеров исключения в иммунных клетках во время беременности остается неизвестной.
Модуляция стероидов внешними факторами
Доступность стероидных гормонов во время беременности, но также не связанных с воспроизводством, может сильно зависеть от внешних факторов. Одним из ключевых примеров является подверженность стрессу, обычно описываемому как сильное восприятие стресса. Хорошо известно, что стрессовые стимулы запускают активацию оси гипоталамус-гипофиз-надпочечники (HPA), что приводит к секреции глюкокортикоидов надпочечниками (рис. 1).Хотя этот нейроэндокринный ответ постепенно ослабевает во время беременности (53), стрессовые стимулы все еще могут вызывать секрецию глюкокортикоидов у мышей и людей (6, 64). Одновременно стрессовые нагрузки снижают уровень прогестерона у млекопитающих во время беременности (65–68). Это может быть результатом нарушения стероидогенеза в яичниках, например, из-за плохой стимуляции лактогенами плаценты (68). Вызванные стрессом глюкокортикоиды могут напрямую влиять на синтез прогестерона, поскольку GR также экспрессируется в яичниках, где в зависимости от экспериментальных условий они, как было показано, стимулируют или ингибируют стероидогенез (69, 70).
Рисунок 1 . «Прегненолон украсть» или как сильное восприятие стресса может привести к истощению запасов прогестерона. Восприятие сильного стресса активирует ось гипоталамус-гипофиз-надпочечники, что приводит к соответствующей секреции кортикотропин-рилизинг-гормона (CRH), адренокортикотропного гормона (ACTH) и кортизола, основного глюкокортикоида у людей. Более того, стресс может повлиять на стероидогенез в периферических тканях. Под стероидогенезом понимается преобразование холестерина в стероидные гормоны посредством ряда этапов.Здесь промежуточный прегненолон является предшественником большинства стероидных гормонов, включая прогестерон и кортизол. При стрессе повышенный синтез кортизола может снизить («украсть») прегненолон, доступный для синтеза последующих гормонов, кроме кортизола. Этот гипотетический сценарий объясняет нарушение выработки прогестерона в ответ на стресс.
Более того, прогестерон и глюкокортикоиды имеют общие стероидогенные пути и предшественники, такие как прегненолон , производный от холестерина (рис. 1).Таким образом, была предложена гипотеза истощения запасов прогестерона в результате продукции глюкокортикоидов в ответ на восприятие высокого стресса (71). Эта гипотеза называется «похищением прегненолона» (71) и подтверждает, что повышенный синтез кортизола, вызванный стрессом, истощает («похищает») доступность прегненолона для синтеза последующих гормонов, кроме кортизола, который впоследствии может также препятствуют синтезу прогестерона. Эта гипотеза требует подтверждения также в контексте беременности.Превращение холестерина в кортизол происходит в митохондриях стероидогенных тканей, лучше всего описанных для коры надпочечников, но также и для различных других тканей, включая первичные лимфоидные органы, кишечник, кожу и мозг (72, 73). Если синтез кортизола также может быть индуцирован, например, стрессом в таких тканях, как яичники и плацента, теоретически это может привести к снижению количества предшественников, доступных для выработки прогестерона во время беременности. Интересно, что в яичниках, основном месте синтеза прогестерона на ранних сроках беременности человека, уже был описан специфический ферментативный механизм выработки глюкокортикоидов (74), и еще предстоит подтвердить, действительно ли кража прегненолона препятствует синтезу прогестерона яичниками в ответ на стресс.
Иммунные пути, опосредованные прогестероном и глюкокортикоидами
Антигенное несоответствие между матерью и плодом не только переносится материнской иммунной системой, но также способствует росту плаценты и плода у мышей (75). Понимание механизмов, с помощью которых поддерживается материнская иммунная толерантность к антигенам плода, не только важно для понимания того, как обеспечивается выживание видов. Такое понимание также позволяет пролить свет на патогенез осложнений беременности.Коллапс материнской иммунной толерантности может проявляться в цитотоксических реакциях на стыке плода и матери и последующей потере плода (21, 76, 77) или нарушении развития плаценты и плода (68, 78).
На сегодняшний день имеется множество данных, которые подчеркивают, что высокие уровни прогестерона критически необходимы для переключения материнского иммунного ответа на толерантность [например, подробно обсуждается в (4)]. Прогестерон способствует формированию толерогенного профиля на подмножествах клеток врожденного иммунитета, таких как макрофаги и дендритные клетки, что важно для успешного ремоделирования ткани матки и поддержания беременности (1–3).Например, in vitro стимуляция прогестагенами индуцирует созревание макрофагов с профилем M2 (79) и предотвращает дифференцировку дендритных клеток в направлении зрелого фенотипа (80). Опосредованная прогестероном модуляция адаптивных иммунных ответов также была исследована на моделях in vivo и in vitro . Здесь прогестерон поддерживает расширение и подавляющую функцию Treg во время беременности, сдвиг в сторону противовоспалительного цитокинового профиля и подавление цитотоксичности CD8 + Т-клеток (20, 68, 81–83).
Несмотря на доступность фармакологических агонистов и антагонистов, специфичных для PR и GR (таблица 1), в экспериментальных вмешательствах во время беременности чаще всего использовался прогестерон в качестве агониста или антагониста RU486, оба из которых могут связывать PR и GR. Следовательно, эти подходы не позволяют дифференцировать индивидуальные эффекты прогестерона или глюкокортикоидов на отдельные подмножества иммунных клеток, что значительно ограничивает понимание индивидуальной роли гормонов или подмножеств клеток в поддержании беременности.Такое ограничение теперь можно легко преодолеть, используя мышей с целенаправленной делецией определенных рецепторов гормонов на отдельных подмножествах иммунных клеток. Фактически, недавние данные показали, что нацеленная делеция PR на дендритных клетках у мышей способствует нетерогенному зрелому фенотипу дендритных клеток, наряду с неспособностью генерировать CD4 + Treg и CD8 + CD122 + Treg. клетки и нарушение развития плаценты и плода (78). Также нацеленная делеция гена GR на Т-клетках у мышей указывает на то, что GR, а не PR является вышестоящим промотором экспансии Treg во время беременности.Подходы In vitro также подтверждают, что GR опосредует экспансию Т-регуляторных клеток путем селективной индукции апоптоза в обычных Т-клетках (9, 10). Эти механизмы задействованы во время беременности, как и в модели экспериментального аутоиммунного энцефаломиелита на мышах, делеция GR в Т-клетках предотвращала вызванное беременностью экспансию Т-регуляторных клеток, а также соответствующее смягчение аутоиммунитета (9).
В этом контексте функциональный анализ вклада передачи сигналов прогестерона через mPR и PGRMC в иммунную регуляцию во время беременности остается в значительной степени труднодостижимым.На сегодняшний день накопление доказательств in vitro подчеркивает важность этих негеномных путей, например, для ответа Т-клеток (20, 29, 84).
Помимо прямого взаимодействия гормон-стероидных рецепторов, прогестерон может косвенно влиять на иммунные реакции. Экспрессия PR в матке и плаценте способствует локальной экспрессии иммуномодулирующих молекул, таких как прогестерон-индуцированный блокирующий фактор (PIBF), галектин-1 (Gal-1) (41, 83) и гемоксигеназа 1 (Hmox1) (68). . Эти мощные иммуномодуляторы имеют решающее значение для установления и продолжения беременности, как показано на моделях мышей и беременностей у людей (41, 68, 83, 85, 86).Например, PIBF может усиливать синтез цитокинов Th3 и ослаблять цитотоксичность NK-клеток (41), тогда как Gal-1 индуцирует толерогенный фенотип в дендритных клетках, что приводит к экспансии Treg (81). В свою очередь, фермент Hmox1 поддерживает генерацию CD8 + CD122 + регуляторных Т-клеток, которые во время беременности способствуют васкуляризации плаценты и росту плода (68). Пути, участвующие в опосредованном прогестероном стимулировании поддержания беременности, также могут включать эпигенетическое подавление ключевых привлекающих Т-клетки воспалительных генов хемокинов в децидуальных стромальных клетках, что наблюдается у мышей при стимуляции прогестероном (87).Это эпигенетическое подавление генов хемокинов может впоследствии подавить накопление антифетальных эффекторных Т-клеток в децидуальной оболочке, тем самым снижая риск потери плода.
Некоторые из индуцированных прогестероном путей в матке также могут быть опосредованы GR. Фактически, хотя глюкокортикоиды кажутся незаменимыми на ранних сроках беременности (88), экспрессия GR в матке имеет решающее значение для обеспечения успешной беременности. Данные, полученные на трансгенных мышах, показывают, что целенаправленная делеция GR в матке приводит к недостаточной фертильности, чрезмерному воспалению и измененному рекрутированию иммунных клеток во время децидуализации (23).
В свете этих недавних наблюдений подчеркивается восходящая роль GR в индуцированной беременностью иммунной толерантности, в то время как появляются новые вопросы о роли прогестерона и глюкокортикоидных негеномных путей. Эти концепции бросают вызов предыдущим представлениям о процессах, происходящих во время беременности, и побуждают не только пересмотреть прежние данные, но и продвинуться в исследовании этих эндокринно-иммунных механизмов с этой новой точки зрения. Следует отметить, что на сегодняшний день доступен ряд технических инструментов для распознавания рецептор-специфических путей (таблица 2), которые обещают впечатляющий прогресс в исследованиях в этой области.
Таблица 2 . Важные технические инструменты, доступные для различения путей, специфичных для стероидных рецепторов.
Влияние прогестерона и глюкокортикоидов на исход беременности и иммунный ответ матери
Учитывая общие стероидогенные пути и транспорт прогестерона и глюкокортикоидов, а также их широко распространенное взаимодействие в иммунных клетках и репродуктивных тканях, есть соблазн предположить, что тесное равновесие между этими стероидами лежит в основе здоровой беременности и развития плода (рис. 2).Как обсуждается ниже, это равновесие может быть нарушено с последствиями для установления или продолжения беременности или затронуть развивающееся потомство (рис. 2). Следовательно, прогестерон и глюкокортикоиды кажутся привлекательными фармакологическими препаратами, например, которые могут восстановить материнскую иммунотолерантность, и их часто добавляют женщинам с риском осложнений беременности.
Рисунок 2 . Во время беременности может иметь место жесткий баланс между глюкокортикоидами и прогестероном.Равновесие между этими гормонами обеспечивает адекватные уровни для поддержания восприимчивости и покоя матки, а также толерогенный иммунный профиль, который в первую очередь способствует васкуляризации плаценты и здоровому росту плода. Напротив, нарушение равновесия прогестерона и / или глюкокортикоидов может не поддерживать беременность и лежать в основе измененного внутриутробного иммунного профиля, склонного к воспалению, что приводит к плацентарной недостаточности и плохому росту плода. Такое нарушение равновесия может иметь первостепенное значение у женщин, страдающих бесплодием или осложнениями беременности, такими как потеря беременности на ранних сроках, преждевременные роды и ЗВУР.Нарушение роста плода и измененное пренатальное воздействие глюкокортикоидов влияет на иммунный онтогенез плода, что может привести к программированию иммунного заболевания плода у потомства. ДК, дендритные клетки; M ϕ , макрофаги; APC, антигенпрезентирующие клетки; ЗВУР, ограничение внутриутробного развития.
Прогестерон, бесплодие и потеря беременности на ранних сроках
Во всем мире около 10% пар испытывают проблемы с фертильностью, при этом мужские и женские факторы почти в равной степени влияют на эти случаи.Интересно отметить, что общее бремя женского бесплодия оставалось одинаковым за последние два десятилетия, несмотря на прогресс в области вспомогательных репродуктивных технологий (95). Помимо бесплодия, потеря беременности на ранних сроках, клинически определяемая как самопроизвольный выкидыш до 20-й недели беременности, встречается у 10–15% здоровых женщин (96). Большая часть самопроизвольных выкидышей происходит из-за неизвестной этиологии, в которой предполагается, что иммунная дезадаптация, например, в ответ на факторы окружающей среды (97), играет решающую роль.
Недостаточность прогестерона и связанная с этим неспособность вызвать соответствующий иммунный ответ, благоприятствующий имплантации эмбриона, часто выдвигались для объяснения этих случаев. Однако на сегодняшний день высокая вариабельность секреции прогестерона и ограничение измерения глюкокортикоидов в повседневной клинической практике затрудняют диагностику дефицита прогестерона или дисбаланса глюкокортикоидов во время нормально прогрессирующей беременности, а также таких патологий, как бесплодие и самопроизвольный выкидыш (98, 99).Учитывая стремительный рост уровня стероидных гормонов во время беременности, эндокринные вмешательства часто используются в парах, страдающих бесплодием или невынашиванием беременности. Женщины с бесплодием, перорально получавшие прогестаген дидрогестерон, который демонстрирует высокое сродство к PR, имели более высокие показатели рождаемости по сравнению с лечением вагинальным микронизированным прогестероном (100). Однако потенциальная модуляция материнского иммунного ответа этими видами лечения не проверялась.
Подобно исследованию бесплодия, описанному выше, лечение дидрогестероном перорально также снижает риск у женщин с повторным невынашиванием беременности в анамнезе, тогда как лечение вагинальным микронизированным прогестероном не снижает риск аборта (101).В этом исследовании уровни цитокинов были протестированы и значительно различались между женщинами с повторяющейся потерей беременности, которым были назначены разные группы лечения, что ограничивает анализ воздействия лечения на иммунные ответы. Для сравнения, отмена или блокировка прогестерона приводит к потере плода у млекопитающих (83, 102, 103), а антагонист PR и GR RU486 эффективно используется для прерывания беременности у человека (104, 105).
Очень желательно изучить механизмы, лежащие в основе защитных эффектов при беременности, вызванных пероральными прогестагенами.Учитывая, что вагинальное введение микронизированного прогестерона не улучшило успешность имплантации у бесплодных пациентов и не привело к снижению частоты абортов, можно предположить, что пероральный способ применения увеличивает системные уровни прогестагена до степени, необходимой для инициирования защитных эффектов при беременности. на материнскую иммунную систему.
Дополнительные доказательства восходящей роли прогестерона в снижении риска патологий беременности получены из более поздних исследований по добавлению прогестагенов на ранних сроках беременности (3, 106, 107).Пониженный прогестерон, например, из-за лютеиновой недостаточности или стресса, может влиять на толерантность матери к антигенам плода и приводить к потере плода (108, 109). Несмотря на обилие информации о взаимодействии между прогестероном и иммунным ответом, на сегодняшний день доступно очень мало информации о причинной связи между измененными уровнями гормонов, коллапсом материнской иммунной толерантности и последующей потерей беременности, которые должны быть рассмотрены в будущих исследованиях.
Из-за их мощной иммунорегуляторной способности глюкокортикоиды являются потенциальным терапевтическим средством у женщин, страдающих от повторной идиопатической неудачной имплантации эмбриона.Кортикоидная терапия становится важным лекарством для пациентов с историей повторных неудачных имплантаций (RIF) после ЭКО / ИКСИ, и по крайней мере часть пациентов реагирует на такое вмешательство (110). Действительно, новые данные, накопленные в небольшой группе пациентов с повышенным количеством NK-клеток в эндометрии, предполагают потенциальные положительные эффекты терапии кортикостероидами (111), поскольку внутриутробная перфузия дексаметазона снижает частоту NK-клеток и приводит к успешной беременности (112).Следует отметить, что безопасность введения глюкокортикоидов во время беременности еще полностью не выяснена (111, 113), и необходимо приложить согласованные усилия для выявления пациентов, которым может быть особенно полезна терапия кортикостероидами (114).
Преждевременные роды
Показатели недоношенности в настоящее время растут не только в развивающихся странах или странах с переходной экономикой, но и во всем мире (115). Как следствие, преждевременные роды являются основной причиной смерти новорожденных во всем мире и основным фактором ухудшения здоровья их потомства.Был достигнут прогресс в прогнозировании риска преждевременных родов, но его этиология все еще остается загадкой. В контексте преждевременных родов все больше признается важность материнской иммунной системы. Сроки родов инициируются сложными путями, которые включают активацию воспалительных сигналов (116). Экспериментальные данные предполагают, что коллапс материнской иммунной адаптации и преждевременная активация воспалительных путей вызывают преждевременные роды (117). Здесь еще предстоит продемонстрировать, следует ли повышающая регуляция воспалительных сигналов после функциональной отмены прогестерона.Фактически было продемонстрировано, что вагинальное применение прогестерона снижает риск преждевременных родов и улучшает перинатальные исходы при одноплодной беременности с короткой шейкой матки у людей, предполагая, что прогестерон обеспечивает покой матки в ткани шейки матки (115). Совсем недавно было продемонстрировано, что лечение прогестероном может быть стратегией для предотвращения преждевременных родов / родов и неблагоприятных неонатальных исходов путем ослабления провоспалительных реакций на границе раздела матери и плода и шейки матки, вызванных активацией Т-клеток (24).
Подобно PR, миометрий экспрессирует GR, хотя и на более низких уровнях (118), и некоторые противовоспалительные действия прогестерона в этой ткани, например, репрессия COX-2 или IL-1β, также может опосредоваться GR (23, 93). ). При доношенных родах активизируются глюкокортикоиды (52). Однако нет сообщений о положительном влиянии глюкокортикоидов на исходы у матери, например, у женщин, получавших дородовую стероидную терапию для созревания легких плода. В целом, потенциальное влияние материнских глюкокортикоидов на модуляцию преждевременных родов еще четко не установлено.
Ограничение внутриутробного развития
Ограничение внутриутробного развития (IUGR) относится к субоптимальному росту плода, состоянию, от которого страдает 3–10% беременностей (119). ЗВУР может быть результатом плацентарной недостаточности, например, из-за нарушения васкуляризации матки или плаценты. Прогестерон может способствовать васкуляризации матки и плаценты различными путями. Например, прогестерон активирует фактор роста плаценты, гомолог VEGF (PlGF) (120), который экспрессируется трофобластами и NK-клетками матки (121, 122).PlGF способствует цитокинезу NK и, следовательно, ремоделированию децидуальных спиральных артерий на ранних сроках беременности и разветвлению сосудов лабиринта на средних и поздних сроках беременности у мышей (122). Действительно, общепризнано, что NK-клетки матки (122) способствуют связанным с беременностью изменениям сосудов матки посредством путей, включая секрецию цитокинов, таких как IFN-γ и IL-17. IFN-γ влияет на сосудистую сеть матки и экспрессию стромальных генов, что приводит к нестабильности сосудов и способствует ремоделированию децидуальных артерий (123).Недавно было также высказано предположение, что прогестерон и эстрадиол запускают апоптоз нейтрофилов, которые переносят белки к Т-клеткам. Эти «индуцированные нейтрофилами Т» (niT) клетки активируют регуляторные маркеры и способствуют росту сосудов in vitro посредством экспрессии IL-17 и VEGF (124).
Более того, на мышиной модели стресса в середине беременности мы наблюдали, что снижение прогестерона было связано с эпигенетическими изменениями в плаценте, которые привели к снижению экспрессии гемоксигеназы-1 (Hmox-1) и ЗВУР.Эти изменения были вызваны увеличением цитотоксических CD8 + Т-клеток, продуцирующих воспалительные цитокины. Этому воспалительному всплеску не препятствовали CD8 + CD122 + Т-регуляторные клетки. Примечательно, что добавление прогестагенов уменьшало ЗВУР за счет восстановления экспрессии Hmox-1, а также подавления воспаления (68).
Интересно, что вызванное стрессом внутриутробное воспаление происходит в среде, богатой глюкокортикоидами (6, 68). Глюкокортикоиды могут влиять на экспрессию и рост плацентарных генов (6, 125), что имеет последствия для питания и газообмена с плодом.Предполагается, что эти эффекты вместе с потенциальным избыточным воздействием глюкокортикоидов на плод лежат в основе ограничения внутриутробного развития плода, то есть в случае ограничения материнского пищевого белка или стресса [обзор в (8)].
Вместе эти наблюдения предоставляют доказательства того, что функции прогестерона и глюкокортикоидов не взаимозаменяемы и что в матке требуется регулируемый баланс для стимулирования роста плода.
Пренатальное воздействие избытка глюкокортикоидов: фетальное программирование постнатального иммунитета
На поздних сроках беременности глюкокортикоиды необходимы для обеспечения структурного и функционального созревания органов у плода (126, 127).Однако пренатальное воздействие скачков глюкокортикоидов пагубно сказывается на росте плода и может иметь серьезные последствия для послеродовой физиологии (8). Избыток глюкокортикоидов у плода может быть вызван, например, приемом дородовых стероидов в случае риска преждевременных родов (128). Кроме того, предполагается, что антенатальное воздействие глюкокортикоидов лежит в основе ряда состояний, таких как материнское недоедание (129), стресс (6) и инфекция (130). У мышей пренатальный стресс и связанный с этим избыток глюкокортикоидов у плода привели к задержке внутриутробного развития (ЗВУР), особенно у потомства женского пола (6).Эти наблюдения можно объяснить специфическими для пола стрессовыми реакциями плаценты, которые ограничивают передачу материнских глюкокортикоидов плоду. Действительно, плаценты от потомства женского пола не смогли активировать плацентарные защитные механизмы, такие как транспортеры 11β-HSD2 и ABC, в ответ на антенатальный стресс, тогда как эти защитные механизмы предотвращали избыток глюкокортикоидов у плодов мужского пола (6).
Растущее количество данных подчеркивает роль пренатального воздействия глюкокортикоидов в онтогенезе иммунитета потомства и нарушении постнатального иммунитета (131, 132).Эти эффекты могут быть многофакторными, включая косвенное и прямое воздействие на иммунную систему (8). Например, пренатальный стресс или избыток глюкокортикоидов могут привести к нарушениям в HPA [см., Например, в (133)]. В целом широко распространено мнение, что постнатальная гипоактивность HPA следует за пренатальным стрессовым воздействием (134). Также наблюдались метаболические нарушения у потомков, подвергшихся пренатальному стрессу или глюкокортикоидам, которые включают программирование фенотипа бережливого метаболизма (135).Как постнатальный HPA, так и метаболизм могут влиять на послеродовой иммунный ответ. Примечательно, что преждевременное воздействие глюкокортикоидов может также повлиять на развивающуюся иммунную систему плода [см. Обзор (8)]. Например, дородовое лечение стероидами привело к рождению новорожденных с нарушением иммунитета (136), например, из-за плохого ответа нейтрофилов (137) и Т-клеток (138).
Заключительные замечания
Недавние данные, полученные на мышах, несущих делеции специфичных для клеток генов, подчеркивают, что пути, расположенные ниже GR в иммунных клетках, критически вовлечены в стимулирование иммунной толерантности во время беременности (9, 10).Поскольку до недавнего времени считалось, что эта толерантность в первую очередь модулируется посредством передачи сигналов через внутриклеточный PR, эти новые наблюдения предлагают пересмотреть аспекты эндокринной иммунной регуляции во время беременности. На ранних сроках беременности такие GR-опосредованные пути, вероятно, вызваны высоким уровнем прогестерона. Однако глюкокортикоиды с высоким сродством к GR превосходят уровни прогестерона на средних и поздних стадиях беременности. Одновременно усиливается воспалительная нагрузка матери из-за кумулятивного воздействия антигенов, происходящих от концепта (139).Оказывает ли преобладание глюкокортикоидов главную иммуномодулирующую роль, остается неизвестным и требует эмпирического подтверждения. Взяв вместе обобщенные данные, возникает соблазн предвидеть близость смены парадигмы в отношении иммунно-эндокринных реакций во время беременности, например, связанных с сигнальными путями или потенциальными методами лечения для повышения иммунной толерантности во время беременности.
Следует отметить, что глюкокортикоиды и прогестерон, по-видимому, находятся в тесном равновесии во время беременности.Даже незначительные нарушения этого равновесия могут иметь серьезные последствия для прогрессирования беременности и развития плода (8, 68) (Рисунок 2). Однако подробная информация об их модуляции и потенциальных ассоциациях с воспалительными механизмами, имеющими место в контексте патологической беременности, остается в значительной степени неуловимой. По крайней мере частично, это связано с тем, что прогестерон и глюкокортикоиды обычно не оцениваются во время беременности. Такие оценки могли бы уточнить идентификацию женщин, которым эндокринная терапия может принести пользу для достижения или поддержки беременности и роста плода.
Наконец, тесное взаимодействие между путями, ведущими вниз по течению к прогестерону и глюкокортикоидам, может иметь терапевтическое значение. В клинической практике глюкокортикоиды широко используются для уменьшения воспаления при патологических условиях. Тем не менее, из-за побочных эффектов их длительного использования, большое количество исследований было предпринято попыток найти активные соединения, которые могли бы заменить кортикостероиды, особенно в качестве хронической терапии. Можно предположить, что прогестерон может быть такой альтернативой.Например, смягчение течения рассеянного склероза у беременных с усилением активности заболевания в послеродовом периоде (140) предполагает иммуномодулирующую роль гормонов, индуцированных беременностью (9, 141). Однако недавнее клиническое испытание не продемонстрировало влияние прогестагенов на предотвращение послеродовых рецидивов у женщин, страдающих рассеянным склерозом (141), что подразумевает ограниченную эффективность лечения, примененного в этом испытании. Следовательно, несмотря на его высокую клиническую значимость, эмпирические данные в поддержку использования прогестагенов в качестве замены глюкокортикоидов на сегодняшний день немногочисленны и требуют тщательного изучения.
Авторские взносы
Оба автора внесли значительный интеллектуальный вклад в работу и одобрили ее к публикации.
Финансирование
Эта работа была поддержана Немецким исследовательским фондом через гранты PCA и MES (AR232 / 25-2, а также SO1413 / 1-2 и SO1413 / 3-1, соответственно).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
3. Гризингер Дж., Турне Х., Маклон Н., Петраглиа Ф., Арк П., Блокил С. и др. Дидрогестерон: фармакологический профиль и механизм действия в качестве поддержки лютеиновой фазы при вспомогательной репродукции. Репродукция Биомед онлайн . (2019) 38: 249–59. DOI: 10.1016 / j.rbmo.2018.11.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Леде Н., Петитбарат М., Шеврие Л., Виту Д., Везмар К., Рахмати М. и др. Иммунный профиль матки может помочь женщинам с повторной необъяснимой неудачей имплантации эмбриона после оплодотворения in vitro . Am J Reprod Immunol . (2016) 75: 388–401. DOI: 10.1111 / aji.12483
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Вечорек А., Перани К.В., Никсон М., Констанция М., Сандовичи И., Зазара Д.Э. и др. Половая регуляция индуцированного стрессом выброса глюкокортикоидов плода плацентой мышей. Am J Physiol Endocrinol Metab . (2019) 317: E109–20. DOI: 10.1152 / ajpendo.00551.2018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Whirledge S, Cidlowski JA. Глюкокортикоиды и размножение: регулирование движения на пути к размножению. Trends Endocrinol Metab . (2017) 28: 399–415. DOI: 10.1016 / j.tem.2017.02.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Солано М.Э., Холмс М.К., Миттельштадт П.Р., Чапман К.Э., Толоса Э. Антенатальные эндогенные и экзогенные глюкокортикоиды и их влияние на иммунный онтогенез и долгосрочный иммунитет. Семин Иммунопатол . (2016) 38: 739–63.DOI: 10.1007 / s00281-016-0575-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Энглер Дж. Б., Курсав Н., Солано М. Е., Патас К., Верманн С., Хекманн Н. и др. Рецептор глюкокортикоидов в Т-клетках обеспечивает защиту от аутоиммунитета во время беременности. Proc Natl Acad Sci USA . (2017) 114: E181–90. DOI: 10.1073 / pnas.1617115114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Хирвегер AM, Энглер JB, Friese MA, Reichardt HM, Lydon J, DeMayo F, et al.Прогестерон модулирует ответ Т-клеток посредством зависимых от рецепторов глюкокортикоидов путей. Am J Reprod Immunol. (2019) 81: e13084. DOI: 10.1111 / aji.13084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Арк П., Солано М.Э., Валецки М., Мейнхардт А. Иммунные привилегии семенников и беременной матки: одинаковая разница? Молекулярный эндокринол . (2014) 382: 509–20. DOI: 10.1016 / j.mce.2013.09.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Лауде В., Гронемейер Х. Книга фактов о ядерных рецепторах . Лондон, Великобритания; Сан-Диего, Калифорния: Academic Press (2002).
Google Scholar
13. Либерман А.С., Будзиньски М.Л., Сокн С., Гоббини Р.П., Штайнингер А., Арцт Э. Регуляторные и механические действия глюкокортикоидов на Т и воспалительные клетки. Фронт-эндокринол . (2018) 9: 235. DOI: 10.3389 / fendo.2018.00235
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Attardi BJ, Zeleznik A., Simhan H, Chiao JP, Mattison DR, Caritis SN, et al.Сравнение связывания рецепторов прогестерона и глюкокортикоидов и стимуляции экспрессии генов прогестероном, 17-альфа-гидроксипрогестерона капроатом и родственными прогестинами. Am J Obstet Gynecol . (2007) 197: 599.e1–7. DOI: 10.1016 / j.ajog.2007.05.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Иссар М., Сахасранаман С., Бухвальд П., Хоххаус Г. Различия в селективности глюкокортикоидов к рецепторам прогестерона при вдыхании глюкокортикоидов. Eur Respir J . (2006) 27: 511–6. DOI: 10.1183 / 0
36.06.00060005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Охасоо Т., Доре Дж. С., Гилберт Дж., Рейно Дж. П. Связывание стероидов с рецепторами прогестина и глюкокортикоидов анализировали с помощью анализа соответствия. J Med Chem . (1988) 31: 1160–9. DOI: 10.1021 / jm00401a015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Мейер К., Шмид Р., Скриба П.С., Велинг М.Очистка и частичное секвенирование высокоаффинных сайтов связывания прогестерона с мембран свиной печени. Eur J Biochem. (1996) 239: 726–31. DOI: 10.1111 / j.1432-1033.1996.0726u.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Thomas P, Pang Y, Dong J, Groenen P, Kelder J, de Vlieg J, et al. Характеристики связывания стероидов и G-белков у подтипов альфа-рецепторов кумжи и прогестиновых мембран человека и их эволюционное происхождение. Эндокринология .(2007) 148: 705–18. DOI: 10.1210 / en.2006-0974
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Марек С.Дж., Уоллес К., Дурвард Э., Корут М., Лил В., Лейпер Л.Дж. и др. Лиганды низкоаффинных сайтов связывания глюкокортикоидов как потенциальные антифиброгенные средства. Сравн. Hepatol . (2009) 8: 1. DOI: 10.1186 / 1476-5926-8-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Лиссауэр Д., Элдершоу С.А., Инман К.Ф., Кумарасами А., Мосс П.А., Килби М.Д.Прогестерон способствует толерантности матери и плода за счет снижения полифункциональности материнских Т-клеток человека и индукции специфического цитокинового профиля. Eur J Immunol . (2015) 45: 2858–72. DOI: 10.1002 / eji.201445404
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Эрлебахер А., Венкато Д., Прайс К.А., Чжан Д., Глимчер Л.Х. Ограничения в презентации антигена серьезно ограничивают распознавание Т-лимфоцитами аллогенного плода. Исследование J Clin . (2007) 117: 1399–411.DOI: 10.1172 / JCI28214
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Dressing GE, Goldberg JE, Charles NJ, Schwertfeger KL, Lange CA. Экспрессия мембранных рецепторов прогестерона в тканях млекопитающих: обзор регуляции и физиологических последствий. Стероиды. (2011) 76: 11–7. DOI: 10.1016 / j.steroids.2010.09.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Whirledge SD, Oakley RH, Myers PH, Lydon JP, DeMayo F, Cidlowski JA.Рецепторы глюкокортикоидов в матке имеют решающее значение для фертильности мышей благодаря контролю имплантации и децидуализации эмбриона. Proc Natl Acad Sci USA . (2015) 112: 15166–71. DOI: 10.1073 / pnas.1508056112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Arenas-Hernandez M, Romero R, Xu Y, Panaitescu B., Garcia-Flores V, Miller D, et al. Эффекторные и активированные Т-клетки вызывают преждевременные роды и роды, которые предотвращаются лечением прогестероном. J Immunol. (2019) 202: 2585–608. DOI: 10.4049 / jimmunol.1801350
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Фернандес М.С., Пьерон В., Михалович Д., Астле С., Торнтон С., Пелтокето Н. и др. Регулируемая экспрессия предполагаемых гомологов мембранных рецепторов прогестина в человеческом эндометрии и гестационных тканях. J Endocrinol. (2005) 187: 89–101. DOI: 10.1677 / joe.1.06242
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Scheschowitsch K, Leite JA, Assreuy J. Новые открытия в передаче сигналов глюкокортикоидного рецептора — больше, чем просто рецептор, связывающий лиганд. Фронт-эндокринол . (2017) 8:16. DOI: 10.3389 / fendo.2017.00016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Mesiano S, Wang Y, Norwitz ER. Рецепторы прогестерона в беременной матке человека: ключ к определению времени родов? Reprod Sci. (2011) 18: 6–19. DOI: 10.1177 / 1
82922
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Dosiou C, Hamilton AE, Pang Y, Overgaard MT, Tulac S, Dong J, et al. Экспрессия мембранных рецепторов прогестерона на человеческих Т-лимфоцитах и клетках Jurkat и активация G-белков прогестероном. J Endocrinol. (2008) 196: 67–77. DOI: 10.1677 / JOE-07-0317
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Кларк NC, Pru CA, Yee SP, Lydon JP, Peluso JJ, Pru JK. Условное удаление компонента 2 мембраны рецептора прогестерона вызывает преждевременное репродуктивное старение самок. Эндокринология. (2017) 158: 640–51. DOI: 10.1210 / en.2016-1701
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Лу К.Д., Радом-Айзик С., Хаддад Ф., Залдивар Ф., Крафт М., Купер Д.М. Экспрессия рецепторов глюкокортикоидов на циркулирующих лейкоцитах различается у здоровых взрослых мужчин и женщин. Дж. Клин. Переводчик. . (2017) 1: 108–14. DOI: 10.1017 / cts.2016.20
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Хенг Т.С., Художник М.В.Консорциум проекта иммунологического генома. Проект иммунологического генома: сети экспрессии генов в иммунных клетках. Нат Иммунол . (2008) 9: 1091–4. DOI: 10.1038 / ni1008-1091
CrossRef Полный текст | Google Scholar
33. Chien EJ, Hsu CH, Chang VH, Lin EP, Kuo TP, Chien CH, et al. В человеческих Т-клетках мифепристон противодействует глюкокортикоидным негеномным быстрым ответам с точки зрения активности Na (+) / H (+) — обмена 1, но не фосфорилирования эзрина / радиксина / моэзина. Стероиды .(2016) 111: 29–36. DOI: 10.1016 / j.steroids.2016.01.004
CrossRef Полный текст | Google Scholar
34. фон Ланген Дж., Фрицемайер К. Х., Дикманн С., Хиллиш А. Молекулярные основы специфичности взаимодействия между глюкокортикоидным рецептором человека и его эндогенным стероидным лигандом кортизолом. ChemBioChem. (2005) 6: 1110–18. DOI: 10.1002 / cbic.200400361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Скарпин К.М., Грэм Дж. Д., Мот, Пенсильвания, Кларк К.Л.Действие прогестерона в тканях человека: регуляция экспрессией изоформы рецептора прогестерона (PR), ядерное позиционирование и экспрессия корегулятора. Ядерный рецепторный сигнал . (2009) 7: e009. DOI: 10.1621 / nrs.07009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Чек JH, Секерес-Барто Дж., Назари П., Кац Y, Чек ML. Желтое тело не является предпосылкой для экспрессии индуцированного прогестероном фактора блокировки Т-лимфоцитами через неделю после имплантации. J Assist Reprod Genet . (2001) 18: 603–7. DOI: 10.1023 / A: 1013113022336
CrossRef Полный текст | Google Scholar
38. Секерес-Барто Дж., Баракони А., Полгар Б., Пар G, Фауст З., Палкович Т. и др. Роль гамма / дельта Т-клеток в иммуномодуляции, опосредованной прогестероном, во время беременности: обзор. Am J Reprod Immunol . (1999) 42: 44–8. DOI: 10.1111 / j.1600-0897.1999.tb00464.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39.Блуа С.М., Иоахим Р., Кандил Дж., Маргни Р., Тометтен М., Клапп Б.Ф. и др. Истощение клеток CD8 + отменяет защитный эффект от беременности замещения прогестерона дидрогестероном у мышей за счет изменения профиля цитокинов Th2 / Th3. Дж. Иммунол . (2004) 172: 5893–9. DOI: 10.4049 / jimmunol.172.10.5893
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Bamberger CM, Else T, Bamberger AM, Beil FU, Schulte HM. Диссоциативная глюкокортикоидная активность ацетата медроксипрогестерона в нормальных лимфоцитах человека. Дж. Клин Эндокринол Метаб . (1999) 84: 4055–61. DOI: 10.1210 / jc.84.11.4055
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Mulac-Jeričević B, Šućurović S, Gulic T., Szekeres-Bartho J. Участие рецептора прогестерона в экспрессии PIBF и Gal-1 в эндометрии мышей. Am J Reprod Immunol . (2019) 81: e13104. DOI: 10.1111 / aji.13104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Арейя А., Вале-Перейра С., Алвес В., Родригес-Сантос П., Сантос-Роса М., Моура П. и др.Может ли мембранный рецептор прогестерона α на Т-регуляторных клетках объяснить последующие роды человека? Дж Репрод Иммунол . (2016) 113: 22–6. DOI: 10.1016 / j.jri.2015.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Маккарти MM. Глава 17: Половая дифференциация мозга и поведения. В: Fink G, Pfaff DW, Levine JE, редакторы. Справочник по нейроэндокринологии . Academic Press (2012) doi: 10.1016 / B978-0-12-375097-6.10017-4
CrossRef Полный текст | Google Scholar
44.LaVoie HA. Лютеиновый стероидогенез. В: Мейдан Р., редактор. Жизненный цикл желтого тела . Чам: Спрингер (2017). п. 37–56. DOI: 10.1007 / 978-3-319-43238-0_3
CrossRef Полный текст | Google Scholar
46. Piekorz RP, Gingras S, Hoffmeyer A, Ihle JN, Weinstein Y. Регулирование уровней прогестерона во время беременности и родов с помощью сигнального преобразователя и активатора транскрипции 5 и 20альфа-гидроксистероиддегидрогеназы. Мол Эндокринол . (2005) 19: 431–40.DOI: 10.1210 / me.2004-0302
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Штраус Дж. Ф. III. Синтез и метаболизм стероидных гормонов. В: Штраус Дж. Ф., Барбьери Р. Л., редакторы. Репродуктивная эндокринология Йена и Яффе: физиология, патофизиология и клиническое управление. Филадельфия: Сондерс Эльзевьер. 6-е изд. (2006). п. 79–104.
Google Scholar
48. Йоханссон Э.Д., Йонассон Л.Е. Уровни прогестерона в околоплодных водах и плазме женщин.I. Уровни при нормальной беременности. Acta Obstet Gynecol Scand. (1971) 50: 339–43. DOI: 10.3109 / 0001634710
35
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Лу Дж., Риз Дж., Чжоу Ю., Хирш Э. Прогестерон-индуцированная активация мембраносвязанных рецепторов прогестерона в мышиных макрофагальных клетках. Дж. Эндокринол . (2015) 224: 183–94. DOI: 10.1530 / JOE-14-0470
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52.Карр Б.Р., Паркер С.Р. младший, Мэдден Дж. Д., Макдональд ПК, Портер Дж. Взаимосвязь адренокортикотропина и кортизола в плазме крови матери на протяжении всей беременности человека. Am J Obstet Gynecol. (1981) 139: 416–22. DOI: 10.1016 / 0002-9378 (81)
-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Дуглас А.Дж. Центральные норадренергические механизмы, лежащие в основе острой стрессовой реакции гипоталамо-гипофизарно-надпочечниковой системы: адаптации во время беременности и кормления грудью. Напряжение .(2005) 8: 5–18. DOI: 10.1080 / 102538
044380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Фриц М.А., Сперофф Л. Клиническая гинекологическая эндокринология и бесплодие . Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс (2012). DOI: 10.1210 / js.2016-1094
CrossRef Полный текст | Google Scholar
55. Кумста Р., Энтрингер С., Хеллхаммер Д.Х., Вуст С. Ответы кортизола и АКТГ на психосоциальный стресс модулируются уровнями глобулина, связывающего кортикостероиды. Психонейроэндокринология . (2007) 32: 1153–7. DOI: 10.1016 / j.psyneuen.2007.08.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Ненке М.А., Зенг А., Мейер Э. Дж., Льюис Дж. Г., Рэнкин В., Джонстон Дж. И др. Дифференциальные эффекты эстрогена на кортикостероидсвязывающие формы глобулина позволяют предположить снижение расщепления во время беременности. J Endocr Soc. (2017) 1: 202–10.
PubMed Аннотация | Google Scholar
57. Batra S, Bengtsson LP, Grundsell H, Sjöberg NO.Уровни свободного и связанного с белками прогестерона в плазме на поздних сроках беременности. Дж. Клин Эндокринол Метаб . (1976) 42: 1041–7. DOI: 10.1210 / jcem-42-6-1041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Coutinho AE, Gray M, Brownstein DG, Salter DM, Sawatzky DA, Clay S, et al. Дефицит 11β-гидроксистероиддегидрогеназы типа 1, но не типа 2, усугубляет острое воспаление и экспериментальный артрит у мышей. Эндокринология. (2012) 153: 234–40.DOI: 10.1210 / en.2011-1398
CrossRef Полный текст | Google Scholar
59. Hirabayashi K, Suzuki M, Takahashi M, Nishihara M. Экспрессия 20альфа-гидроксистероид дегидрогеназы яичников в тимусе крысы. Endocr J . (2001) 48: 557–63. DOI: 10.1507 / endocrj.48.557
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Ihle JN, Pepersack L, Rebar L. Регулирование дифференцировки Т-клеток: in vitro индукция 20 альфа-гидроксистероид дегидрогеназы в лимфоцитах селезенки от бестимусных мышей уникальным лимфокином. J Immunol. (1981) 126: 2184–9.
PubMed Аннотация | Google Scholar
61. Xu H, Medina S, Lauer FT, Douillet C, Liu KJ, Hudson LG и др. Транспортеры оттока регулируют индуцированную арсенитом генотоксичность в дважды отрицательных и дважды положительных Т-клетках. Toxicol Sci . (2017) 158: 127–39. DOI: 10.1093 / toxsci / kfx075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Таннер С.М., Стейли Е.М., Лоренц Р.Г. Измененная генерация индуцированных регуляторных Т-клеток в FVB.mdr1a — / — мышиная модель колита. Иммунол слизистой оболочки . (2013) 6: 309–23. DOI: 10,1038 / миль.2012.73
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Fröhlich M, Albermann N, Sauer A, Walter-Sack I, Haefeli WE, Weiss J. In vitro и ex vivo доказательства модуляции активности P-гликопротеина прогестинами. Биохим Фармакол . (2004) 68: 2409–16. DOI: 10.1016 / j.bcp.2004.08.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64.Berghänel A, Heistermann M, Schülke O, Ostner J. Пренатальный стресс ускоряет рост потомства, чтобы компенсировать сокращение материнских инвестиций у млекопитающих. Proc Natl Acad Sci USA . (2017) 114: E10658–66. DOI: 10.1073 / pnas.1707152114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Arck PC, Rücke M, Rose M, Szekeres-Bartho J, Douglas AJ, Pritsch M, et al. Факторы раннего риска выкидыша: проспективное когортное исследование беременных женщин. Репродукция Биомед онлайн .(2008) 17: 101–13. DOI: 10.1016 / S1472-6483 (10) 60300-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Крил С., Винни Дж. А. младший, Кристиансон Д. Глюкокортикоидные гормоны стресса и влияние риска хищничества на воспроизводство лосей. Proc Natl Acad Sci USA . (2009) 106: 12388–93. DOI: 10.1073 / pnas.0
5106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Димак-Штол К.А., Дэвис К.С., Греб Н.М., Стоунхилл А.С., Грин Л.К., Митчелл Дж. И др.Заболеваемость и биомаркеры беременности, самопроизвольного аборта и неонатальной потери при воздействии стрессора окружающей среды: последствия для подавления репродуктивной функции самок у совместно разводимых сурикатов. Physiol Behav. (2018) 193 (Pt A): 90–100. DOI: 10.1016 / j.physbeh.2017.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Солано М.Э., Коваль М.К., О’Рурк Г.Е., Хорст А.К., Модест К., Плёш Т. и др. Прогестерон и HMOX-1 способствуют росту плода за счет модуляции CD8 + Т-клеток. Дж. Клин Инвест . (2015) 125: 1726–38. DOI: 10.1172 / JCI68140
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Ченнинг С.П., Цай В., Сакс Д. Роль инсулина, тироксина и кортизола в лютеинизации клеток гранулезы свиней, выращенных в средах с определенным химическим составом. Биол Репрод . (1976) 15: 235–47. DOI: 10.1095 / biolreprod15.2.235
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Майкл А.Э., Пестер Л.А., Кертис П., Шоу Р.В., Эдвардс К.Р., Кук Б.А.Прямое ингибирование стероидогенеза яичников кортизолом и модулирующая роль 11 β-гидроксистероиддегидрогеназы. Клин Эндокринол . (1993) 38: 641–4. DOI: 10.1111 / j.1365-2265.1993.tb02147.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Майхилл С., Робинсон С. Диагностика и лечение синдрома хронической усталости и миалгического энцефалита: это митохондрии, а не гипокондрии . Лондон: Книги Хаммерсмит (2017).
Google Scholar
73.Taves MD, Gomez-Sanchez CE, Soma KK. Экстраадреналовые глюкокортикоиды и минералокортикоиды: данные о местном синтезе, регуляции и функции. Am J Physiol Endocrinol Metab . (2011) 301: E11–24. DOI: 10.1152 / ajpendo.00100.2011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Амвег А.Н., Родригес Ф.М., Хубер Э., Марелли Б.Е., Гарейс Н.С., Белотти Е.М. и др. Обнаружение и активность 11-бета-гидроксилазы (CYP11B1) в яичнике крупного рогатого скота. Репродукция .(2017) 153: 433–41. DOI: 10.1530 / REP-16-0493
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Мадейя З., Яди Х., Аппс Р., Буленуар С., Ропер С.Дж., Гарднер Л. и др. Отцовская экспрессия MHC на трофобласте мыши влияет на васкуляризацию матки и рост плода. Proc Natl Acad Sci USA . (2011) 108: 4012–7. DOI: 10.1073 / pnas.1005342108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Першелле А.Л., Ясти С., Петров М.Г.Материнский CD4? и CD8? Толерантность Т-клеток к минорному антигену гистосовместимости плода у мышей, трансгенных по рецепторам Т-клеток. Биол Репрод . (2013) 89: 102. DOI: 10.1095 / биолрепрод.113.110445
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Ким К. Х., Чой Б. К., Ким Дж. Д., Ким Ю. Х., Ли С. К., Сух Дж. Х. и др. Передача сигналов 4–1BB нарушает толерантность материнских CD8 + Т-клеток, которые реагируют с аллоантигенами. PLoS ONE . (2012) 7: e45481. DOI: 10,1371 / журнал.pone.0045481
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Тиле К., Хирвегер А.М., Рикельме Джиа, Солано М.Э., Лайдон Дж. П., Арк П.С. Нарушение реакции дендритных клеток CD11c + на прогестерон влияет на образование регуляторных Т-клеток CD4 + и связано с ограничением внутриутробного роста у мышей. Фронт эндокринол. (2019) 10:96. DOI: 10.3389 / fendo.2019.00096
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79.Цай Ю.К., Цзэн Д.Т., Ван С.Й., Су М.Т., Хуанг Дж.Й., Го П.Л. Медроксипрогестерона ацетат приводит к дифференцировке макрофагов M2 по фенотипу децидуальных макрофагов. Mol Cell Endocrinol. (2017) 452: 74–83. DOI: 10.1016 / j.mce.2017.05.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Xiu F, Anipindi VC, Nguyen PV, Boudreau J, Liang H, Wan Y, et al. Высокие физиологические концентрации прогестерона обращают опосредованные эстрадиолом изменения дифференцировки и функций дендритных клеток костного мозга. PLoS ONE . (2016) 11: e0153304. DOI: 10.1371 / journal.pone.0153304
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Мао Г, Ван Дж, Кан Й, Тай П, Вэнь Дж, Цзоу Кью и др. Прогестерон увеличивает системные и местные пропорции в матке CD4 + CD25 + Treg-клеток во время промежуточной беременности у мышей. Эндокринология. (2010) 151: 5477–88. DOI: 10.1210 / en.2010-0426
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82.Шумахер А., Даувен Д., Зенклассен А.С. Индукция местных регуляторных Т-клеток, управляемая прогестероном, не предотвращает гибель плода в модели CBA / J × DBA / 2J, склонной к аборту. Am J Reprod Immunol . (2017) 77: e12626. DOI: 10.1111 / aji.12626
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Блуа С.М., Иларреги Дж. М., Тометтен М., Гарсия М., Орсал А. С., Кордо-Руссо Р. и др. Ключевая роль галектина-1 в толерантности плода и матери. Нат Мед . (2007) 13: 1450–7.DOI: 10,1038 / нм1680
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Поликарпова А.В., Левина И.С., Сигай Н.В., Заварзин И.В., Морозов И.А., Рубцов П.М. и др. Иммуномодулирующие эффекты прогестерона и селективных лигандов мембранных рецепторов прогестерона. Стероиды. (2019) 145: 5–18. DOI: 10.1016 / j.steroids.2019.02.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Тирадо-Гонсалес И., Фрейтаг Н., Барриентос Г., Шайклы В., Нагаева О., Странд М. и др.Галектин-1 влияет на уклонение трофобластов от иммунной системы и выступает в качестве фактора прогноза исхода беременности. Мол Хум Репрод. (2013) 19: 43–53. DOI: 10,1093 / мольч / газ043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Нэнси П., Таглиани Э., Тай С.С., Асп П., Леви Д.Е., Эрлебахер А. Подавление гена хемокина в децидуальных стромальных клетках ограничивает доступ Т-клеток к интерфейсу матери и плода. Наука. (2012) 336: 1317–21. DOI: 10.1126 / наука.1220030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Montano MM, Wang MH, vom Saal FS. Половые различия в уровне кортикостерона в плазме у плодов мышей опосредуются дифференциальным плацентарным транспортом от матери и устраняются материнской адреналэктомией или стрессом. J Reprod Fertil . (1993) 99: 283–90. DOI: 10.1530 / jrf.0.09
CrossRef Полный текст | Google Scholar
89. Рённер Т.Л., Бродич П., Дусетт С., Турек-Этьен Т., Мюллер-Виейра Ю., Сонневельд Е. и др.Селективность и эффективность ретропрогестерона дидрогестерона in vitro . Стероиды. (2011) 76: 607–15. DOI: 10.1016 / j.steroids.2011.02.043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Като М., Хагивара Ю., Ода Т., Имамура-Такай М., Аоно Х., Накамура М. Благоприятные фармакологические эффекты селективного агониста рецепторов глюкокортикоидов при внешних заболеваниях глаз. J Ocul Pharmacol Ther. (2011) 27: 353–60. DOI: 10.1089 / jop.2010.0177
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Лео Дж. К., Го С., Вун Коннектикут, Aw SE, Лин В. К.. Перекрестная связь глюкокортикоидов и минералокортикоидов с рецептором прогестерона для индукции очаговой адгезии и торможения роста в клетках рака груди. Эндокринология. (2004) 145: 1314–21. DOI: 10.1210 / en.2003-0732
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Джадав С.П., Пармар Д.М. Улипристала ацетат, модулятор рецепторов прогестерона для экстренной контрацепции. J Pharmacol Pharmacother. (2012) 3: 109–11. DOI: 10.4103 / 0976-500X.95504
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Лей К., Чен Л., Георгиу Э.С., Сооранна С.Р., Ханджани С., Бросенс Дж. Дж. И др. Прогестерон действует через ядерный глюкокортикоидный рецептор, подавляя IL-1β-индуцированную экспрессию COX-2 в человеческих клетках миометрия. PLoS One. (2012) 7: e50167. DOI: 10.1371 / journal.pone.0050167
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94.Аго Й, Арикава С., Ята М., Яно К., Абэ М., Такума К. и др. Подобные антидепрессантам эффекты антагониста глюкокортикоидных рецепторов RU-43044 связаны с изменениями префронтального дофамина на мышиных моделях депрессии. Нейрофармакология . (2008) 55: 1355–63. DOI: 10.1016 / j.neuropharm.2008.08.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Mascarenhas MN, Flaxman SR, Boerma T, Vanderpoel S, Stevens GA. Национальные, региональные и глобальные тенденции распространения бесплодия с 1990 г .: систематический анализ 277 обследований состояния здоровья. ПЛоС Мед . (2012) 9: e1001356. DOI: 10.1371 / journal.pmed.1001356
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Ford HB, Schust DJ. Рецидивирующая потеря беременности: этиология, диагностика и терапия. Rev Obstet Gynecol. (2009) 2: 76–83.
PubMed Аннотация | Google Scholar
99. Паломба С., Фалбо А., Чиосси Дж., Мускогиури Дж., Форнакиари Е., Орио Ф. и др. Липидный профиль у беременных женщин без ожирения с синдромом поликистозных яичников: проспективное контролируемое клиническое исследование. Стероиды . (2014) 88: 36–43. DOI: 10.1016 / j.steroids.2014.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Tournaye H, Sukhikh GT, Kahler E, Griesinger G. Рандомизированное контролируемое исследование фазы III, сравнивающее эффективность, безопасность и переносимость перорального дидрогестерона и микронизированного вагинального прогестерона для лютеиновой поддержки при оплодотворении in vitro . Hum Reprod. (2017) 32: 1019–27. DOI: 10.1093 / humrep / dex023
CrossRef Полный текст | Google Scholar
101.Кумар А., Бегум Н., Прасад С., Аггарвал С., Шарма С. Пероральное лечение дидрогестероном на ранних сроках беременности для предотвращения повторного невынашивания беременности и его роль в модуляции выработки цитокинов: двойное слепое, рандомизированное, параллельное, плацебо-контролируемое исследование. Fertil Steril. (2014) 102: 1357–63.e3. DOI: 10.1016 / j.fertnstert.2014.07.1251
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Ян Б., Чжоу Х. Дж., Хэ Ц. Дж., Фанг Р. Я. Прерывание беременности на ранних сроках у мышей, крыс и хомяков с помощью DL111-IT и RU486. Контрацепция. (2000) 62: 211–6. DOI: 10.1016 / S0010-7824 (00) 00160-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Наутиал Дж., Кумар П.Г., Лалорая М. Мифепристон (Ru486) противодействует подавлению хемотаксического белка-3 моноцитов на ранних сроках беременности мышей, выявляя иммуномодулирующие эффекты при аборте, вызванном Ru486. Am J Reprod Immunol. (2004) 52: 8–18. DOI: 10.1111 / j.1600-0897.2004.00176.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104.Уорден С., Генкин И., Хум С., Данн С. Результаты раннего проведения абортов с применением мифепристона и буккального мизопростола до 63 дней беременности в канадских клинических условиях. J Obstet Gynaecol Can. (2019) 41: 647–52. DOI: 10.1016 / j.jogc.2018.05.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Хсиа Дж. К., Лор П. А., Тейлор Дж., Крейнин Мэриленд. Медикаментозный аборт мифепристоном и вагинальным мизопростолом между 64 и 70 днями беременности. Контрацепция .(2019) 100 (3): 178–81. DOI: 10.1016 / j.contraception.2019.05.006
CrossRef Полный текст | Google Scholar
107. Хаас DM, Hathaway TJ, Ramsey PS. Прогестаген для профилактики выкидыша у женщин с повторным невынашиванием неясной этиологии. Кокрановская база данных Syst Rev. (2018) 10: CD003511. DOI: 10.1002 / 14651858.CD003511.pub4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Friebe A, Douglas AJ, Solano E, Blois SM, Hagen E, Klapp BF и др.Нейтрализация LPS или блокировка передачи сигналов TLR4 предотвращает вызванную стрессом потерю плода при беременности у мышей. Дж Мол Мед . (2011) 89: 689–99. DOI: 10.1007 / s00109-011-0743-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Prados MB, Solano ME, Friebe A, Blois S, Arck P, Miranda S. Стресс увеличивает экспрессию VCAM-1 на фето-материнском интерфейсе в модели мышей, склонной к абортам. Reprod Immunol. (2011) 89: 207–11. DOI: 10.1016 / j.jri.2011.01.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Леде Н., Прат-Элленберг Л., Петитбарат М., Шеврие Л., Саймон С., Ирани Е.Е. и др. Влияние преднизона на пациентов с повторными неудачными имплантациями эмбрионов: полезно или пагубно? J Reprod Immunol. (2018) 127: 11–5. DOI: 10.1016 / j.jri.2018.03.003
CrossRef Полный текст | Google Scholar
111. Krigstein M, Sacks G. Преднизолон при повторной неудачной имплантации, связанной с высоким уровнем естественных клеток-киллеров. J Obstet Gynaecol. (2012) 32: 518–9. DOI: 10.3109 / 01443615.2012.693988
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Zhang T, Huang C, Du Y, Lian R, Mo M, Zeng Y, Mor G. Успешное лечение с внутриматочной доставкой дексаметазона при повторной неудачной имплантации. Am J Reprod Immunol. (2017) 78: e12766. DOI: 10.1111 / aji.12766
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Motteram C, Vollenhoven B, Hope N, Osianlis T, Rombauts LJ.Показатели живорождений после комбинированной адъювантной терапии в циклах ЭКО-ИКСИ: исследование случай-контроль. Reprod Biomed. (2015) 30: 340–8. DOI: 10.1016 / j.rbmo.2014.12.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Робертсон С.А., Джин М., Ю.Д., Молденхауэр Л.М., Дэвис М.Дж., Халл М.Л. и др. Кортикостероидная терапия при вспомогательной репродукции — подавление иммунитета — ложная предпосылка. Hum Reprod. (2016) 31: 2164–73. DOI: 10.1093 / humrep / dew186
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115.Ромеро Р., Конде-Агудело А., Да Фонсека Е., О’Брайен Дж. М., Цетингоз Е., Кризи Г. В. и др. Вагинальный прогестерон для предотвращения преждевременных родов и неблагоприятных перинатальных исходов при одноплодной беременности с короткой шейкой матки: метаанализ индивидуальных данных пациентов. Am J Obstet Gynecol. (2018) 218: 161–80. DOI: 10.1016 / j.ajog.2017.11.576
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Конде-Агудело А., Ромеро Р. Вагинальный прогестерон для предотвращения преждевременных родов у беременных с сонографической короткой шейкой матки: клинические последствия и последствия для общественного здравоохранения. Am J Obstet Gynecol. (2016) 214: 235–42. DOI: 10.1016 / j.ajog.2015.09.102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Георгиу Э.С., Лей К., Лай П.Ф., Юлия А., Герберт Б.Р., Кастелланос М. и др. Изучение действия прогестерона на эксплантаты миометрия человека. Мол Хум Репрод. (2016) 22: 877–89. DOI: 10,1093 / мольхр / gaw037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Ромо А., Карселлер Р., Тобахас Дж.Задержка внутриутробного развития (ЗВУР): эпидемиология и этиология. Pediatr Endocrinol Rev. (2009) 6 (Suppl. 3): 332–6.
PubMed Аннотация | Google Scholar
120. Русли Д.К., Сумапраджа К., Раджуддин Р., Хасбаллах К. Повышение уровня PlGF (фактора роста плаценты) после введения дидрогестерона во время беременности. В: 6-й Конгресс Азиатско-Тихоокеанской инициативы по репродукции (Aspire 2016) . Джакарта. DOI: 10.18502 / kme.v1i1.530
CrossRef Полный текст | Google Scholar
121.Breier G, Albrecht U, Sterrer S, Risau W. Экспрессия фактора роста эндотелия сосудов во время эмбрионального ангиогенеза и дифференцировки эндотелиальных клеток. Развитие . (1992) 114: 521–32.
PubMed Аннотация | Google Scholar
122. Рэтсеп М.Т., Фелкер А.М., Кей В.Р., Толуссо Л., Хофманн А.П., Крой Б.А. Естественные клетки-киллеры матки: контролеры построения сосудистой сети в ранней децидуальной оболочке. Репродукция. (2015) 149: R91–102. DOI: 10.1530 / REP-14-0271
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123.Ашкар А.А., Ди Санто Дж. П., Крой Б.А. Гамма-интерферон способствует инициации модификации сосудов матки, децидуальной целостности и созреванию естественных клеток-киллеров матки во время нормальной беременности мышей. J Exp Med. (2000) 192: 259–70. DOI: 10.1084 / jem.192.2.259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Надкарни С., Смит Дж., Сферруцци-Перри А. Н., Ледвозыв А., Кишор М., Хаас Р. и др. эутрофилы индуцируют проангиогенные Т-клетки с регуляторным фенотипом во время беременности. Proc Natl Acad Sci USA . (2016) 2016: 11944. DOI: 10.1073 / pnas.1611944114
CrossRef Полный текст | Google Scholar
125. Хаттер С., Хепп П., Хофманн С., Кун С., Месснер Дж., Андергассен Ю. и др. Глюкокортикоидные рецепторы α и β модулируют пол, в частности, в плаценте человека с ограничением внутриутробного развития (IUGR). Arch Gynecol Obstet. (2019) 300: 323–35. DOI: 10.1007 / s00404-019-05189-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126.Venihaki M, Carrigan A, Dikkes P, Majzoub JA. Циркадный подъем материнского глюкокортикоида предотвращает легочную дисплазию у плодов мышей с надпочечниковой недостаточностью. Proc Natl Acad Sci USA . (2000) 97: 7336–41. DOI: 10.1073 / pnas.97.13.7336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127. Krude H, Grüters A. Последствия мутаций проопиомеланокортина (POMC) у людей: синдром дефицита POMC. Trends Endocrinol Metab. (2000) 11: 15–22.DOI: 10.1016 / S1043-2760 (99) 00213-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128. Diepenbruck I, Much CC, Krumbholz A, Kolster M, Thieme R, Thieme D, et al. Влияние пренатального лечения стероидами на развивающуюся иммунную систему. Дж Мол Мед . (2013) 91: 1293–302. DOI: 10.1007 / s00109-013-1069-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
129. Коттрелл Е.С., Холмс М.С., Ливингстон, Делавэр, Кеньон С.Дж., Секл Дж. Р.. Согласование пищевых и глюкокортикоидных гипотез программирования плода. FASEB J. (2012) 26: 1866–74. DOI: 10.1096 / fj.12-203489
PubMed Аннотация | CrossRef Полный текст | Google Scholar
131. Чанг Х.Й., Сух Д.И., Ян С.И., Кан М.Дж., Ли С.И., Ли Э. и др. Пренатальный материнский дистресс влияет на атопический дерматит у потомства, опосредованный окислительным стрессом. J Allergy Clin Immunol. (2016). 138: 468–475.e5. DOI: 10.1016 / j.jaci.2016.01.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
132. Хенриксен Р. Э., Туен Ф.Качество брака и стресс во время беременности предсказывают риск инфекционных заболеваний у потомства: норвежское когортное исследование матери и ребенка. PLoS ONE . (2015) 10: e0137304. DOI: 10.1371 / journal.pone.0137304
CrossRef Полный текст | Google Scholar
134. Иегуда Р., Энгель С.М., Бранд С.Р., Секл Дж., Маркус С.М., Берковиц Г. Трансгенерационные эффекты посттравматического стрессового расстройства у младенцев матерей, подвергшихся нападениям Всемирного торгового центра во время беременности. Дж. Клин Эндокринол Метаб .(2005) 90: 4115–8. DOI: 10.1210 / jc.2005-0550
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136. Робертс Д., Далзил С. Антенатальные кортикостероиды для ускорения созревания легких плода для женщин с риском преждевременных родов. Кокрановская база данных Syst Rev . (2006) 3: CD004454. DOI: 10.1002 / 14651858.CD004454.pub2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137. Барак М., Коэн А., Гершковиц С. Изменения общего количества лейкоцитов и нейтрофилов, связанные с антенатальным введением бетаметазона у недоношенных детей. Acta Paediatr . (1992) 81: 760–3. DOI: 10.1111 / j.1651-2227.1992.tb12098.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138. Чабра С., Коттрилл С., Райенс М.К., Кросс Р., Липке Д., Брюс М. Подмножества лимфоцитов в пуповинной крови недоношенных детей: влияние дородовых стероидов. Биол Новорожденных . (1998) 74: 200–7. DOI: 10.1159 / 000014025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
139. Робертсон С.А., Кэр А.С., Молденхауэр Л.М.Регуляторные Т-клетки при имплантации эмбриона и иммунный ответ на беременность. J Clin Invest. (2018) 128: 4224–35. DOI: 10.1172 / JCI122182
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Confavreux C, Hutchinson M, Hours MM, Cortinovis-Tourniaire P, Moreau T. Частота рецидивов рассеянного склероза, связанных с беременностью. N Engl J Med . (1998) 339: 285–91. DOI: 10.1056 / NEJM1998073033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
141.Vukusic S, Ionescu I, El-Etr M, Schumacher M, Baulieu EE, Cornu C и др. Профилактика послеродовых рецидивов прогестином и эстрадиолом в группе исследования рассеянного склероза. Профилактика послеродовых рецидивов с помощью прогестина и эстрадиола в исследовании рассеянного склероза (POPART’MUS): обоснование, цели и состояние прогресса. J Neurol Sci. (2009) 286: 114–8. DOI: 10.1016 / j.jns.2009.08.056
CrossRef Полный текст | Google Scholar
Примерный график пренатального развития
На этой странице представлен подробный обзор человеческого развития с момента соединения сперматозоидов с яйцеклеткой до рождения.Пренатальное развитие делится на три триместра. В течение первых двух месяцев развивающийся человек называется эмбрионом. У эмбриона три слоя, из которых развиваются все органы тела. Во втором триместре развивающийся человек называется плодом. В третьем триместре это ребенок, который в случае преждевременного рождения может выжить при дополнительной поддержке. Преждевременные роды до третьего триместра с меньшей вероятностью выживут, даже при чрезвычайной медицинской помощи в отделении интенсивной терапии новорожденных.
Первый триместр
Первый месяц
Оплодотворение, оплодотворение яйцеклетки из трубки в матку. Раннее деление клеток и формирование зародышевого диска, из которого разовьется новый организм. Раннее образование трех слоев клеток: (1) эктодерма, из которой разовьются органы чувств и нервная система (2) мезодерма, из которой разовьются кровеносная, скелетная и мышечная системы (3) энтодерма, из которой пищеварительная и некоторые другие железистые системы будут развиваться. В матке образуется особый слой клеток, который станет плацентой, через которую питательные вещества будут переноситься в новый организм, а продукты жизнедеятельности уносятся.Особый слой клеток образует амнион или водяной мешок, который окружает развивающийся эмбрион, за исключением пуповины. Формируется сердечная трубка, которая начинает пульсировать, заставляя кровь циркулировать по кровеносным сосудам в эмбриональном диске. Нервная система начинает формироваться сначала в виде нервной борозды. Начинается развитие кишечника, легких, печени и почек. К концу месяца эмбрион вырастает примерно на четверть дюйма в длину, свернувшись в форме полумесяца, с небольшими бугорками по бокам тела, указывающими на зарождающиеся руки и ноги.
Второй месяц
Эмбрион увеличивается в размере примерно до 1½ дюйма. Кости и мышцы начинают округлять контуры тела. Лицо и шея развиваются и начинают приобретать черты человеческого облика. Лоб очень выпуклый, что свидетельствует о преждевременном развитии мозга по сравнению с остальным телом. Почки конечностей удлиненные. Развиваются мышцы и хрящи. Начинают формироваться половые органы.
Третий месяц
Начало периода плода. Половая дифференциация продолжается: мужские половые органы демонстрируют более быстрое развитие, а женские половые органы остаются более нейтральными.заложены почки на все 20 временных зубов. Появляются голосовые связки; пищеварительная система проявляет активность. Клетки желудка начинают выделять жидкость; печень изливает желчь в кишечник. Почки начинают функционировать, моча постепенно просачивается в околоплодные воды. Другие продукты жизнедеятельности попали через плаценту в кровь матери. Кости и мышцы продолжают развиваться, и к концу третьего месяца возможны самопроизвольные движения рук, ног, плеч и пальцев.
Второй триместр
Четвертый месяц
В нижней части тела наблюдается относительно ускоренная скорость, так что размер головы уменьшается с половины до одной четвертой размера тела.Спина прямая, кисти и стопы правильной формы. Кожа выглядит темно-красной из-за того, что кровь просвечивает сквозь тонкую кожу и морщины из-за отсутствия подстилающего жира. Возможно закрытие пальца. Рефлексы становятся более активными по мере продолжения мышечного созревания. Плод начинает шевелиться и поэтому выталкивает руки и ноги движениями, легко воспринимаемыми матерью.
Пятый месяц
Структуры кожи начинают приобретать окончательную форму. Формируются и функционируют потовые и сальные железы.Также появляются кожные производные — волосы, ногти на пальцах рук и ног. Костная ось становится довольно прямой, и возникает большая спонтанная активность. Плод худощавый и морщинистый, около 30 см в длину и весит около фунта.
Шестой месяц
Веки, которые были закрыты после третьего месяца, открываются заново; глаза полностью сформированы. Вкусовые рецепторы появляются на языке и во рту, и их больше, чем у младенцев или взрослых.
Третий триместр
Седьмой месяц
С этого времени организм способен к самостоятельной жизни.Полушария головного мозга покрывают почти весь мозг. Семимесячный плод может давать различные специализированные реакции. Обычно около 15 дюймов в длину и весит около трех фунтов.
Восьмой и девятый месяц
В это время наносятся последние штрихи на различные органы и функциональные возможности. Жир быстро образуется по всему телу, разглаживая морщинистую кожу и округляя контуры тела. Тускло-красный цвет кожи бледнеет, так что пигментация лицевой пигментации обычно очень незначительна у всех рас.Активность обычно велика, и он может изменить свое положение в несколько переполненной матке. Периоды активности будут чередоваться с периодами покоя. Органы плода активизируют свою деятельность. Сердцебиение плода становится довольно быстрым. Органы пищеварения продолжают выделять больше продуктов жизнедеятельности, что приводит к образованию фетального стула, называемого меконием, который выделяется вскоре после рождения. Начинаются сильные сокращения матки, хотя более легкие из них переносятся раньше, и в конечном итоге плод изгнан из матки к независимому физиологическому существованию.
Пренатальное развитие из Википедии
Атлас динамических ландшафтов хроматина в развитии плода мыши
Сбор тканей
Все работы с животными были рассмотрены и одобрены Национальным лабораторным комитетом по благополучию и исследованиям животных лаборатории Лоуренса Беркли. Сбор тканей для всех стадий развития проводили с использованием штамма C57BL / 6N Mus musculus животных. Для E14.5 и P0 племенных животных приобретали как в Charles River Laboratories (штамм C57BL / 6NCrl), так и в Taconic Biosciences (штамм C57BL / 6NTac).Для всех оставшихся стадий развития племенных животных закупали исключительно в Charles River Laboratories (штамм C57BL / 6NCrl). Самцов и самок мышей дикого типа спаривали, используя стандартную стратегию разведения по времени. Эмбрионы и детенышей P0 были собраны для вскрытия с использованием утвержденных институциональных протоколов. Эмбрионы исключались, если они не находились на ожидаемой стадии развития. Чтобы избежать деградации образца, одновременно обрабатывали только один эмбриональный помет или детеныш P0, а ткань во время вскрытия поддерживали ледяной.Пробирки для сбора для каждого типа ткани помещали в баню с сухим льдом и этанолом, чтобы образцы ткани можно было мгновенно заморозить сразу после вскрытия. Ткани из нескольких эмбрионов собирали вместе в одной и той же пробирке для сбора, и по меньшей мере две отдельные пробирки для сбора собирали для каждой стадии ткани для биологической репликации. Ослепление экспериментатора не проводилось для рассечения ткани, так как не оценивались отдельные группы лечения и контроля. Рандомизация была невозможна из-за масштабов производства.Ткань хранили в морозильной камере при -80 ° C или на сухом льду до дальнейшей обработки. Пошаговый протокол сбора тканей, включая подробную информацию о том, как определялась эмбриональная стадия, можно найти на веб-сайте проекта ENCODE по адресу https://www.encodeproject.org/documents/631aa21c-8e48-467e-8cac-d40c875b3913 /@@download/attachment/StandardTissueExcisionProtocol_02132017.pdf.
Генерация данных ChIP – seq
Полная серия данных ChIP – seq включает более 66 миллиардов считываний секвенирования из 564 экспериментов ChIP – seq, каждый из которых состоит из двух биологических реплик, полученных из разных пулов эмбрионов ( n = всего 1 128 реплик) .ChIP-seq эксперименты для всех меток и тканей от E11.5 до P0 были выполнены, как описано ранее 5 . Протокол ChIP-seq был немного изменен для всех экспериментов E10.5 из-за небольшого количества входных данных (micro-ChIP-seq). Подробные протоколы как для стандартных, так и для микро-ChIP-seq, включая используемые антитела и выполненные проверки антител, доступны на https://www.encodeproject.org/, связанные с каждым экспериментом, описанным здесь. Их также можно найти по ссылкам ниже.
Стандартный ChIP – seq (E11.5 – P0)
Фиксация тканей и обработка ультразвуком: https://www.encodeproject.org/documents/3125496b-c833-4414-bf5f-84dd633eb30d/@@download/attachment/Ren_Tissue_Fixation_and_Sonication_v060614. Иммунопреципитация: https://www.encodeproject.org/documents/89795b31-e65a-42ca-9d7b-d75196f6f4b3/@@download/attachment/Ren%20Lab%20ENCODE%20Chromatin%20Immunoprecipitation%20Protocol_V2.pdf. Подготовка библиотеки: https://www.encodeproject.org/documents/4f73fbc3-956e-47ae-aa2d-41a7df552c81/@@download/attachment/Ren_ChIP_Library_Preparation_v060614.pdf.
Micro-ChIP – seq (E10.5)
Фиксация тканей и обработка ультразвуком: https://www.encodeproject.org/documents/1fcaab50-6ca0-4778-88cb-5f6b85170d21/@@download/attachment/Ren%20Lab % 20ENCODE% 20Tissue% 20Fixation% 20and% 20Sonication% 20Protocol% 20MicroChIP.pdf. Иммунопреципитация и подготовка библиотеки: https://www.encodeproject.org/documents/18580e80-0907-4258-a412-46bcc37bd040/@@download/attachment/Ren%20Lab%20ENCODE%20Chromatin%20Immunoprecipitation%20ProtocolIP%20MicroCh.
Генерация данных ATAC – seq
Полный ряд данных ATAC – seq включает более 7 миллиардов считываний секвенирования из 66 экспериментов ( n = всего 132 репликации).Наша процедура ATAC – seq основана на ранее опубликованном методе 8 с модификациями для оптимизации замороженных тканей. Вкратце, ткани измельчали с помощью ступки и пестика в жидком азоте, а затем проводили пермеабилизацию ядер путем ресуспендирования в буфере для пермеабилизации ядер (PBS, 1 мМ DTTm 0,2% IGEPAL-CA630, 5% BSA, 1 × коктейль из полного ингибитора протеазы). , и инкубация с очень осторожным вращением при 4 ° C. Наш полный протокол ATAC – seq доступен на портале данных ENCODE здесь: https: // www.encodeproject.org/documents/4a2fc974-f021-4f85-ba7a-bd401fe682d1/@@download/attachment/RenLab_ATACseq_protocol_20170130.pdf. Нам требовалось минимум 20 миллионов используемых пар чтения ATAC – seq на набор данных и минимальная доля перекрывающегося при чтении TSS (FROT) 0,1 (расширенные данные рис. 3). Мы используем FROT как меру отношения сигнал / шум в наборах данных ATAC-seq, потому что TSS широко маркируются открытым хроматином, даже в тканях, в которых ген не экспрессируется. Мы вычисляем FROT для каждой библиотеки как количество операций чтения, которые отображаются в пределах 1 КБ от TSS GENCODE v4, деленное на общее количество используемых операций чтения.Данные ATAC-seq хорошо воспроизводимы между биологическими репликами одной и той же тканевой стадии, как измерено с помощью корреляции Пирсона и Спирмена (расширенные данные, рис. 3). Кроме того, многомерный масштабный анализ обогащения ATAC-seq по идентифицированным пикам подтверждает, что образцы имеют тенденцию группироваться в первую очередь по типам тканей, а затем по стадиям развития (Extended Data Fig. 3).
Обработка и анализ данных ChIP – seq
Единый конвейер обработки
Данные Histone ChIP – seq были проанализированы с помощью программного конвейера, реализованного Координационным центром данных ENCODE (DCC) для Консорциума ENCODE.Каждый шаг конвейера соответствует сценарию, написанному на языке программирования Python, который собирает входные файлы, запускает внешние программы (например, вызывающий пик MACS2) и вычисляет показатели контроля качества. Методология аналогична методике, описанной ранее для ENCODE 62 , со следующими изменениями: на этапе отображения использовались bwa версии 0.7.10 и samtools версии 1.0, а MACS2 версии 2.1.0 использовался для генерации дорожки сигнала и пикового вызова. Чтобы гарантировать адекватную выборку шума для последующих повторных сравнений, пики первоначально вызывались с ослабленным порогом P , равным 1 × 10 -2 .Такие расслабленные наборы пиков были сгенерированы для каждой биологической реплики, для объединенных реплик и для объединенных псевдорепликатов каждой истинной реплики (каждая псевдорепликация состоит из половины считываний, отобранных без замены). Пики из объединенного набора реплик сохранялись в наборе реплицированных пиков, если они перекрывались по крайней мере на половину своей длины (в основаниях) пиков из обоих биологических повторов. Кроме того, к набору реплицированных пиков были добавлены пики, которые перекрывали оба объединенных псевдорепликатора.Таким образом, очень сильные биологические реплики могли «спасти» пики, которые были лишь маргинальными во второй реплике. Этот конвейер доступен для запуска на веб-платформе DNAnexus (https://www.dnanexus.com/), поддерживаемой облачными вычислениями из Amazon Web Services (AWS), и представляет собой тот же конвейер, который используется для анализа всех гистонов ENCODE. ChIP – seq эксперименты. Платформа предоставляет как API для программного выполнения конвейера, так и веб-интерфейс для интерактивного выполнения одних и тех же рабочих процессов.ENCODE DCC использует этот подход для обеспечения единообразной обработки первичных данных из разных лабораторий Консорциума и, таким образом, для минимизации факторов, которые могут затруднить последующие сравнения 63 . ENCODE DCC проанализировал эксперименты параллельно и предоставил результаты на портале ENCODE 62 (https://www.encodeproject.org/).
Анализ данных по отдельным гистоновым меткам
Для облегчения сравнений по стадиям был создан один список пиков для каждой метки для каждой ткани путем объединения реплицированных пиков по стадиям в каждой ткани.Затем каждый пик оценивался с использованием обогащения ChIP – seq кратности ввода на каждом этапе в соответствующей ткани с использованием bigWigAverageOverBed (https://github.com/ENCODE-DCC/kentUtils/blob/master/bin/linux.x86_64/bigWigAverageOverBed), и с использованием важных моментов либо из реплики 1, либо из реплики 2, как указано. Эти значения были нормированы квантилем по стадиям, чтобы исключить потенциальные искажающие эффекты систематических ошибок в распределении сигнала между стадиями. Эти нормализованные таблицы оценок (по одной на метку, ткань, повтор) были использованы для анализа, приведенного ниже.
Сравнения между образцами
Для корреляции между повторами каждого эксперимента мы использовали корреляцию Пирсона, как показано на рис. 2d с расширенными данными. Узкие отметки (h4K4me3, h4K4me2, h4K27ac и h4K9ac) имеют более узкие пики обогащения и имеют тенденцию коррелировать сильнее, чем широкие отметки (h4K27me3, h4K4me1, h4K9me3 и h4K36me3). Для корреляции между стадиями мы использовали корреляцию Пирсона для сравнения повторов, как указано выше, для каждой метки, но сравнивая все стадии друг с другом в пределах одной ткани и одной метки.Затем мы классифицировали эти корреляции в зависимости от того, сколько стадий разделяет сравниваемые наборы данных: например, ноль для истинных биологических реплик с той же стадии или семь для сравнения наборов данных E11.5 с наборами данных P0. Эти корреляции показаны на рис. 1д. Для дальнейшего облегчения сравнений по тканям был использован подход, аналогичный подходу, описанному выше в разделе «Анализ данных по отдельным гистоновым меткам», но в этом случае был создан один главный список пиков для каждой метки путем слияния реплицированных пиков по всем этапам ткани.Как и выше, каждый пик затем оценивался с использованием ChIP-seq-кратного обогащения по входу на каждой стадии ткани, но в этом случае с использованием данных, объединенных из обоих повторов (объединенные данные). Затем эти значения были нормализованы квантилем по стадиям ткани, и полученные в результате таблицы основных оценок (по одной на каждую отметку) были использованы для иерархической кластеризации, выполняемой в R с параметрами по умолчанию. Полученные дендрограммы представлены на рис. 4а с расширенными данными. Для h4K27ac k -означает кластеризацию на рис.1, перед кластеризацией был выполнен один дополнительный этап обработки данных: по каждой строке значения были преобразованы в единичный вектор в R ( x / √ (сумма ( x 2 )), чтобы предотвратить доминирование кластеров в общем уровне обогащения.Эти значения единичного вектора использовались только для кластеризации; нанесенные на график значения являются нормализованными значениями обогащения h4K27ac из таблиц оценок, описанных выше. K — означает, что кластеризация была выполнена в R с k = 8 и параметрами по умолчанию. Строки были упорядочены в каждом кластере на основе среднего нормализованного обогащения.
Анализ главных компонентов
Весь геном был разделен на тайлинги размером 1 kb. Сигналы среднего кратного обогащения были рассчитаны для каждого бина с использованием bigWigAverageOverBed.Бины, которые перекрывали объединенный пик минимум на 20% (обратно), были обозначены как интервалы пиков. Сигналы среднего кратного обогащения от каждого пикового интервала были нормализованы квантилем в пределах данной ткани. Сила сигнала для каждого пика рассчитывалась как сумма сигналов всех элементов разрешения, которые перекрывали этот пик. Анализ главных компонентов выполняли по пиковым сигналам для каждой гистоновой метки с помощью R-функции «prcomp». Значения PC1, PC2 и PC3 были нанесены на график для каждого образца.
Профили метагена
Для иллюстрации характерных паттернов обогащения в активных и молчащих генах в расширенных данных Рис.1b, мы использовали консервативные определения «активных» генов как считываний на килобазу транскрипта на миллион отображенных считываний (RPKM)> 10 на каждой оцениваемой здесь стадии ткани, а «молчащие» гены были определены как RPKM <2 на всех тканевых стадиях. . Профили метагена были построены с помощью программы deeptools plotProfile 64 с использованием данных из сердца E15.5.
Обработка и анализ данных ATAC – seq
Единый конвейер обработки
Данные ATAC – seq были проанализированы с использованием стандартизированного программного конвейера, разработанного ENCODE DCC для Консорциума ENCODE для выполнения анализа контроля качества и считывания выравнивания.Чтения ATAC-seq были обрезаны с помощью специального сценария адаптера и сопоставлены с mm10 с использованием Bowtie версии 2.2.6 и samtools версии 1.2 для устранения дубликатов ПЦР. MACS2 версии 2.1.1.20160309 использовался для генерации сигнальных треков и пиковых вызовов со следующими параметрами: —nomodel —shift 37 —ext 73 —pval 1e-2 -B —SPMR —call-summit. Чтобы получить набор «реплицированных» пиков ATAC-seq для анализа, описанные выше шаги определения пика были выполнены для каждой пары реплик независимо, а также для объединенного набора данных из обеих реплик.Для идентификации набора реплицированных пиков, который мы определяем как подмножество пиков, вызываемых в объединенном наборе, которые также независимо присутствовали в обоих наборах реплицируемых пиковых вызовов, использовался инструмент IntercctBed из набора bedtools v2.27.1.
Каталог d-TAC
Чтобы получить единый каталог d-TAC, который может обеспечить многомерный анализ по всем 66 стадиям ткани, вышеупомянутые повторяющиеся наборы пиков для каждого образца были объединены, объединены, отсортированы и затем помечены с использованием Инструменты mergeBed и sortBed из пакета bedtools v2.27.1 люкс. Был использован инструмент IntersectBed для связывания каждого d-TAC с исходными тканевыми стадиями, на которых были доступны его составляющие пики. Каталог был далее разделен на категории TSS дистальный или проксимальный на основании окна размером ± 1 kb вокруг TSS GENCODE v4.
Чтобы оценить чувствительность наших вызовов пиков при обнаружении потенциальных цис- -регуляторных элементов, мы вычислили истинную положительную частоту или долю восстановленных пиков для каждой применимой стадии ткани относительно двух эталонных наборов: активно транскрибируемых промоторов; и энхансеры из базы данных энхансеров VISTA (по состоянию на 22 июля 2017 г.) с активностью на E11.5. Используя согласованную последовательность РНК, загруженную с https://www.encodeproject.org/, транскрипты с количеством ≥10 TPM были классифицированы как активно транскрибируемые для каждой тканевой стадии.
Специфичность каталога оценивалась путем расчета истинно отрицательной скорости d-TAC на каждой стадии ткани по сравнению с TSS GENCODE v4, которые были недоступны для согласованной последовательности DNase-seq с https://www.encodeproject.org/. Чтобы дополнительно исследовать тканеспецифичность каталога d-TAC, перекрытие между d-TAC для каждой ткани на E11.5, и энхансеры, которые проявляли активность в соответствующем паттерне ткани, рассчитывали и сравнивали с фоновой частотой попаданий энхансеров с активностью в любом паттерне. Значимость обогащения рассчитывалась с использованием биномиального теста.
Для расчета обогащения в состояниях ChromHMM каталог d-TAC перекрывался с вызовами аутосомных состояний ChromHMM для каждой стадии ткани (объединенный или повторяющийся набор вызовов, как указано). Обогащение для данного состояния с на конкретной стадии ткани было рассчитано как наблюдаемое количество пар оснований каталога d-TAC, которые перекрывают состояние с , деленное на общее количество пар оснований, которые, как ожидается, будут перекрывать состояние с на основе охвата генома (общее покрытие п.н. каталога d-TAC × доля генома, охваченная состоянием s ).
Динамические d-TAC
Чтобы идентифицировать дифференциально доступные d-TAC, для каждого d-TAC в унифицированном каталоге мы подсчитали количество считываний ATAC – seq, которые перекрывали d-TAC для каждой стадии ткани и реплицировались с использованием функция покрытия в bedtools v2.27.1. Для каждой ткани d-TAC на любой стадии были классифицированы как динамические во времени, если они показали значительное изменение доступности (кратное изменение ≥2, P ≤ 0,05) между любыми последовательными этапами развития с использованием DEseq2.
Чтобы исследовать взаимосвязь между изменениями в доступности и изменениями в состоянии хроматина, динамические d-TAC были классифицированы как повышающиеся (положительный лог [кратное изменение]) или теряющие (отрицательный лог [кратное изменение]) доступности. Для каждого перехода стадии ткани ( n к n + 1) эти наборы d-TAC с усилением или потерей доступности перекрывались с вызовами состояния ChromHMM для стадий n и n + 1 Обогащение рассчитывали путем взятия наблюдаемой доли динамических пар оснований, перекрывающих каждую комбинацию состояний (состояние при n , состояние при n + 1) и деления на ожидаемую долю пар оснований, перекрывающих каждую комбинацию состояний на основе динамические и нединамические d-TAC.
Чтобы исследовать временную взаимосвязь между h4K27ac и доступностью хроматина, динамические сильные энхансеры (реплицированные, состояние ChromHMM U5) на каждом этапе перехода перекрывались с d-TAC для соответствующей ткани, чтобы идентифицировать совпадающие энхансеры и d-TAC. В случаях, когда более одного d-TAC перекрывали энхансер, выбирали d-TAC с наибольшим числом перекрывающихся пар оснований. Последовательный логарифм [кратное изменение] в сигнале ATAC-seq оценивали при каждом возможном переходе между стадиями для этих совпадающих d-TAC и принимали среднее значение.Эти стадии-переходы были преобразованы в «смещения» относительно сильных энхансеров, а кратные изменения усреднены с целью получения глобального тренда (то есть для динамических энхансеров на E11.5 – E12.5; E11.5 – E12. .5 — смещение 0, E12.5 – E13.5 — смещение 1, и так далее, пока E16.5 – P0 не станет смещением 5). Обратный анализ был также выполнен для оценки логарифма [кратного изменения] h4K27ac при динамических d-TAC.
Корреляционная карта d-TAC
Корреляционная карта между d-TAC была сгенерирована для каждой хромосомы путем вычисления коэффициента корреляции Пирсона (PCC) для каждой пары d-TAC с использованием счетчиков чтения ATAC – seq, нормированных на RPKM и log 2 — преобразовано с малым псевдосчетом.Мы определяем «коррелированные d-TAC» как таковые в одном и том же TAD (как определено эмбриональными стволовыми (ES) клетками мыши) с попарным PCC ≥ 0,7.
Чтобы оценить корреляции d-TAC как функцию геномного расстояния, мы присвоили каждому d-TAC ячейку размером 10 kb. Для каждого бина A была измерена корреляция между его d-TAC и таковыми из бина B на различных расстояниях от 10 кб до 2 Мб. Среднее значение этих корреляций по всем хромосомам было построено как функция расстояния.Кроме того, чтобы исследовать правомерность использования границ TAD ES-клеток мыши в качестве ограничения для корреляционной карты, сравнивали средние корреляции между d-TAC на различных геномных расстояниях для пар, расположенных в одном и том же TAD, и пар, не разделяющих TAD. Достоверность разницы в корреляции между парами d-TAC внутри TAD и между TAD рассчитывалась с использованием критерия рангового знака Вилкоксона.
Обогащение вариантов каталога GWAS человеческими ортологами d-TAC
Для обеспечения возможности сравнения с GWAS человеческих фенотипов мы использовали liftOver с настройками по умолчанию для преобразования d-TAC из mm10 в геномные координаты hg19.Затем мы определили новые d-TAC, удалив те, которые перекрывали сайты гиперчувствительности к ДНКазе из любой клеточной линии или ткани в двух опубликованных наборах данных 9,36 , один из которых включал эмбриональную ткань. Мы получили варианты индекса для всех признаков в каталоге GWAS (https://www.ebi.ac.uk/gwas/api/search/downloads/full) и сохранили уникальный набор вариантов, которые были идентифицированы как значимые для всего генома ( P <5 × 10 −8 ) в GWAS лиц европейского происхождения.Чтобы получить фоновый набор вариантов для тестирования обогащения, мы использовали отфильтрованные варианты индекса в качестве входных данных для SNPsnap 60 , который соответствует на основе (1) частоты минорного аллеля, (2) расстояния до ближайшего аннотированного гена, (3) плотность генов в окружающем регионе и (4) количество SNP в неравновесном сцеплении (LD) со следующими параметрами: европейская популяция, десять совпадающих SNP, исключая HLA SNP и входные SNP, и сообщают о скоплении. Поскольку варианты индекса GWAS не обязательно являются причинными и могут находиться в LD с истинным причинным вариантом, мы затем определили локусы для всех индексных и сопоставленных фоновых вариантов как все SNP с высоким LD ( r 2 > 0.8) с вариантом в European 1000 Genomes 65 образцов с использованием PLINK v1.90p 66 . Затем мы подсчитали количество GWAS и фоновых локусов по крайней мере с одним вариантом, которые перекрывают либо все d-TAC, либо новые d-TAC, и использовали гипергеометрический тест для оценки значимости обогащения локусов GWAS по сравнению с совпадающими фоновыми локусами.
Обогащение фенотипов и сложных заболеваний в человеческих ортологах энхансеров d-TAC
Чтобы проверить обогащение сложных фенотипов и заболеваний общедоступной сводной статистикой, мы сначала определили наборы человеческих ортологов энхансеров d-TAC.Для каждой ткани мы свернули все сильные и слабые состояния хроматина энхансера (En-Sd, En-Sp, En-W) по временным точкам и использовали liftOver для преобразования геномных координат из mm10 в hg19. Затем мы пересекли ортологичные энхансеры с ортологичными d-TAC, чтобы получить набор ортологичных энхансеров d-TAC для каждой ткани. Мы собрали сводную статистику по 41 человеческому признаку и заболеванию (дополнительная таблица 11), преобразовав отношения шансов и доверительные интервалы в логарифмические отношения шансов и стандартные ошибки для бинарных признаков и оценив частоты аллелей из европейского подмножества 1000 геномов, недоступных из сводных данных.Мы использовали polyTest 61 для тестирования обогащения вариантов эффектов на каждый фенотип в аннотациях ортологичного энхансера d-TAC с параметрами «–univariate – maf 0.05 – high-mem». Мы использовали иерархическую кластеризацию в подписанном логарифме 10 ( P ) для обогащений, которые были нормализованы в пределах z -баллов для группировки сходных фенотипов.
Обогащение фенотипов и заболеваний клеточного типа в переднем мозге мыши
Мы получили совокупные пики доступного хроматина для каждого кластера клеток в переднем мозге мышей P56 и удалили пики, которые перекрывали промоторы (2 т.п.н. выше TSS RefSeq mm10), сохранив наборы Промотор-дистальные пики 38 .Для этого анализа мы не ограничивали пики состояниями хроматина энхансера, так как это потенциально может смещать результаты для типов клеток, которые были чрезмерно представлены в основной ткани. Мы преобразовали геномные координаты для промотор-дистальных пиков из mm10 в hg19 с помощью liftOver. Затем мы использовали polyTest для оценки специфического для клеточного типа обогащения фенотипов и заболеваний, которые показали, по крайней мере, номинально значимое обогащение ( P <0,05) в d-TAC переднего мозга мыши из предыдущего анализа. Мы использовали иерархическую кластеризацию по z — нормализованный по результатам знаковый журнал 10 ( P ) для обогащения, как описано в предыдущем анализе, и построили график результатов для признаков, которые показали, по крайней мере, номинальную значимость по крайней мере в одном кластере ячеек.
ChromHMM
Мы отмечаем, что аннотации состояния хроматина, представленные здесь, относятся к данному исследованию и отличаются от более крупных усилий Центра анализа данных ENCODE по интеграции данных всего консорциума в всеобъемлющую «энциклопедию». Мы также отмечаем, что мы исключили E10.5 из анализа ChromHMM, потому что на этой стадии не было полного набора из восьми профилей модификации гистонов, и тестирование показало, что модели только с шестью метками не смогли уловить полный набор состояний, полученных из восьми меток (расширенные данные, рис.7). Однако мы предоставляем набор аннотаций ChromHMM с использованием модели с шестью отметками на E10.5 на нашем веб-сайте здесь: http://renlab.sdsc.edu/renlab_website//download/encode3-mouse-histone-atac/.
Создание модели
Наборы данных хроматина (файлы .bam) были загружены из ENCODE DCC 15 октября 2016 г. Дедуплицированные файлы .bam для каждого образца вместе с соответствующими элементами управления вводом были преобразованы в двоичную форму с использованием функции binarizeBam из ChromHMM с параметрами по умолчанию. Модели, учитывающие 2–24 состояния, изучались отдельно на двух репликах с помощью функции LearnModel с параметрами по умолчанию.Для остальной части анализа мы использовали доступность двух различных повторяющихся временных рядов; а именно, мы применили ту же стратегию отдельно и сравнили результаты апостериори. Полученные выводы неизменно согласовывались, предполагая, что выводы по одному временному ряду (по крайней мере, с точки зрения глобальных геномных паттернов) хорошо воспроизводимы.
Идентификация оптимального количества состояний хроматина
Мы разработали две стратегии для определения минимального количества состояний, которые фиксируют комбинации модификаций гистонов, присутствующих в данных, оба из которых сходятся на модели с 15 состояниями.Сначала функция ChromHMM CompareModels запускалась отдельно для двух серий. Эта функция сравнивает параметры выбросов выбранной модели с набором моделей (с точки зрения корреляции Пирсона) и выводит максимальную корреляцию каждого состояния в выбранной модели с наиболее подходящим состоянием в каждой другой модели. Мы использовали эту функцию для сравнения «полной» модели (той, которая учитывает 24 состояния) с состояниями в более простых моделях. Затем мы вычислили медианную корреляцию всех 24 состояний по сравнению с более простыми моделями, нанесли эти числа на график в зависимости от количества состояний в модели и посмотрели на количество состояний, в которых обе серии достигли плато.В качестве дополнительной стратегии вероятности выбросов из всех 23 моделей (с учетом 2–24 состояний) из обеих реплик были сгруппированы вместе. Обоснование этой стратегии состоит в том, что очень похожие состояния в моделях будут иметь тенденцию к объединению, поэтому должно быть оптимальное количество кластеров, соответствующее оптимальному количеству состояний в модели. С этой целью мы применили k -средний кластеризацию с k между 2 и 24, и оценили степень точности разделения для каждого k как отношение между «суммой квадратов между» (называемое Между SS ) и «общая сумма квадратов» (Total SS).Очень сплоченные, хорошо разделенные кластеры имеют тенденцию приближаться к коэффициенту 1. При значении k соотношение было усреднено по сотне реализаций кластеризации. Отношение, наблюдаемое для k = 24, использовалось как максимальное, а оптимальное количество состояний было затем определено наименьшим значением k , которое показало отношение, равное или превышающее 95% от максимума. Для сравнения модели с восемью отметками и моделью с шестью отметками (расширенные данные рис.7) мы использовали 66 этапов ткани, для которых у нас был полный набор восьми отметок, а затем субдискретизация до шести отметок (h4K4me1, h4K4me3, h4K27ac, h4K27me3, h4K9me3 и h4K26me3) и повторили описанный выше анализ, чтобы прийти к оптимальному количеству состояний.Затем мы сравнили модель с 8 отметками и 15 состояниями с моделями с 6 отметками с двумя разными числами состояний (11 состояний и 16 состояний), представляющими минимум и максимум оптимального диапазона, соответственно.
Сегментация генома и отслеживание состояния хроматина по позициям генома.
Сегментация проводилась отдельно для каждого образца с использованием функции MakeSegmentation ChromHMM (параметры по умолчанию) и модели, полученной из первой реплики. Для окончательного набора реплицированных вызовов состояния мы потребовали, чтобы область была назначена одному и тому же состоянию в обеих биологических репликациях (в пределах данной ткани и стадии).Области, которые не были отнесены к одному и тому же состоянию в обоих повторах, были переклассифицированы как «отсутствие воспроизводимого сигнала» (в отличие от состояния 15: отсутствие сигнала в обоих повторах). Функциональность unionbedg BEDTools 67 v2.17.0 использовалась для отслеживания состояния хроматина геномных интервалов в определенном наборе образцов. Общий охват аннотированной последовательности составляет 2 725 535 600 п.н. Это число использовалось в качестве знаменателя для расчета процента покрытия генома на основе состояний ChromHMM в тексте и на рисунках.
Траектории состояния хроматина во время развития
Учитывая реплику для определенной ткани, все те геномные интервалы, классифицированные в определенном состоянии (например, номер 5, сильные энхансеры) в одной или нескольких временных точках, отслеживались с использованием подхода, описанного выше . Затем с учетом каждой пары смежных временных точек развития рассчитывали геномный охват каждого перехода между каждой парой состояний. Затем полученные числа были нормализованы по охвату самого большого перехода во временном ряду исследуемых (например, печень, реплика номер 2) и отображены в виде ориентированного графика.
Кластеризация по состояниям энхансеров
После отслеживания изменений состояния хроматина каждой пары геномных оснований в геноме на нескольких этапах и тканях, полученная матрица была преобразована в двоичную форму в соответствии с каждым сегментом, классифицируемым в определенном состоянии (1) или любом другом. состояние (0). Затем были рассчитаны бинарные расстояния между всеми парами образцов, рассматриваемых в каждом конкретном анализе. Они использовались либо для сравнения, либо для иерархической кластеризации (метод Уорда).
Анализ GO
Функциональное обогащение через GREAT 68 было получено с помощью скрипта greatBatchQuery.py. Полученные списки сначала были отфильтрованы по соответствующим онтологиям. После этого учитывались только члены, показывающие биномиальное FDR ≤ 0,05 и региональное обогащение, равное или превышающее двукратное. Проверенные VISTA элементы были загружены с https://enhancer.lbl.gov 17 июня 2016 года. Координаты Mm9 и hg19 были преобразованы в mm10 с помощью функции liftOver (для — minMatch установлено значение 0.95 и 0,1 соответственно). Для следующего анализа учитывались положительные элементы VISTA с любой из следующих аннотаций: передний мозг, средний мозг, задний мозг, нервная трубка, конечность, мезенхима лица или сердце. Печень не рассматривалась в этом анализе обогащения, поскольку в настоящее время в VISTA имеется менее 10 проверенных элементов, которые показывают воспроизводимое окрашивание в печени. Покрытие из BEDTools v2.17.0 использовалось для расчета покрытия регионов в каждом состоянии в прогнозах E11.5 с каждой тканеспецифичной группой элементов VISTA.Затем доля покрытых оснований была нормализована к ожидаемому перекрытию на основе общего охвата генома каждого состояния. Обогащение повторяющихся элементов рассчитывалось с использованием функции OverlapEnrichment ChromHMM.
Классификация генов как предполагаемых мишеней PcG
Окно размером 2 т.п.н. было определено вокруг координат TSS всех кодирующих белок транскриптов в GENCODE 69 vM9. Эти 2-килобайтные окна перекрывались вызовами ChromHMM («объединенный» набор) для определения их состояния хроматина в каждой ткани и на каждой стадии.TSS классифицируется как активный на данной стадии ткани, если это окно размером 2 т.п.н. перекрывает состояние активного промотора (состояние № 1, рис. 1a) и не перекрывает какие-либо репрессивные состояния (состояния 3, 13, 14). TSS был классифицирован как репрессированный на данной стадии ткани, если это окно размером 2 т.п.н. перекрывало состояние, характерное для состояния репрессии, опосредованного поликом (состояние 13), и не перекрывало какие-либо активные состояния (состояния 1, 2, 4, 5, 6, 7, 10, 12). TSS, которые не соответствовали критериям активности или репрессии на данной тканевой стадии, оставались неклассифицированными.Ген был классифицирован как предполагаемая мишень для PcG, если он имел хотя бы один репрессированный TSS хотя бы на одной тканевой стадии. Чтобы определить, были ли ранее идентифицированы гены, которые мы идентифицировали как предполагаемые мишени для PcG, мы сравнили наши данные с пятью опубликованными исследованиями, в которых изучается распределение белков h4K27me3 и / или PcG по всему геному 13,29,30,31,32 , включая набор данных NIH Epigenome Roadmap, который исследовал более 100 типов человеческих выборок. Для исх. 29,30 , любой ген с TSS, аннотированным как h4K27me3-позитивный в любом образце (независимо от других меток), считался ранее идентифицированной мишенью PcG.Для исх. 31,32 , любой ген, отнесенный к одному из состояний «PRC» в любом образце, считался ранее идентифицированной мишенью PcG. Для исх. 13 , вызовы состояний ChromHMM для 127 человеческих образцов были загружены 31 марта 2018 г. (набор вызовов «15_coreMarks_mnemonics»). Предполагаемые гены-мишени PcG в этом наборе данных были идентифицированы, как описано выше для наших мышиных вызовов ChromHMM, со следующими модификациями: набор аннотаций GENCODE v27 использовался для человека (gencode.v27lift37.annotation.gtf.gz), а рассматриваемые состояния гетерохроматина, связанные с Polycomb, были «13_ReprPC», «14_ReprPCWk» и «10_TssBiv». Любой ген, по крайней мере, с одним TSS, перекрывающим одно из этих состояний по крайней мере в одном образце, считался ранее идентифицированной мишенью PcG. Ensembl v84 использовали для сопоставления идентификаторов генов мыши с идентификаторами ортологичных генов человека (attribute = hsapiens_homolog_ensembl_gene). Для анализа CpG список островов CpG с соответствующими значениями (длина GC #, CpG #, GC%, CpG%) был загружен из обозревателя таблиц UCSC 8 января 2018 г. и перекрывался со списком TSS с использованием bedtools v2.20.1. Если TSS перекрывает более одного CGI, соответствующие значения всех перекрывающихся CGI объединяются и связываются с перекрывающимся TSS.
Классификация генов как MDG и / или TF
Мы получили список генов Менделирующей болезни из https://www.omim.org/ 70 (genemap2.txt, по состоянию на 14 января 2018 г.). Чтобы отфильтровать гены, связанные со сложными заболеваниями или фенотипами, не связанными с болезнями, мы выполнили следующие шаги фильтрации. 1) Мы потребовали, чтобы гены были отнесены к типу 3 (молекулярная основа расстройства известна).2) Мы потребовали, чтобы ген имел хотя бы один ассоциированный фенотип, который не заключен в скобки (не заболевания) или скобки (многофакторные расстройства) или не содержит вопросительного знака (связь между фенотипом и геном является условной). 3) Мы также потребовали, чтобы человеческий ген Ensembl ID уникально картировался с одним Ensembl ID мыши. 4) Наконец, мы рассмотрели только аутосомы, поскольку для ChIP-seq использовались смешанные пулы помета. Эти шаги фильтрации привели к набору из 3281 гена, который мы классифицировали как Цели развития тысячелетия.Чтобы идентифицировать гены TF, мы загрузили список TF мыши из базы данных TFClass 71 (по состоянию на 18 февраля 2017 г.). В качестве альтернативных источников генов TF для поддержки результатов TFClass мы использовали DBD: базу данных прогнозирования факторов транскрипции 72 и гены, связанные с одним или несколькими терминами GO, содержащими фразу ‘TF’, как определено AmiGO 73 (доступ на 14 января 2018 г., taxon_subset_closure_label: Mus musculus , document_category: bioentity). AmiGO также использовался таким образом для идентификации генов, связанных с одним или несколькими GO-терминами, содержащими слово «развитие» (расширенные данные, рис.12). Гены, по крайней мере, с одним транскриптом, помеченным как консенсусная кодирующая последовательность (CCDS) в GENCODE, были классифицированы как CCDS на рис. 12.
Характеристика динамических энхансерных элементов
Временной динамический анализ выполняли для каждой ткани отдельно. Во-первых, были идентифицированы геномные бины размером 1 т.п.н., которые перекрывались с областями, определенными как сильные энхансерные состояния ChromHMM, по крайней мере, на одной стадии. Затем мы выбрали динамические элементы (бины) из этих бинов сильных энхансеров, используя биокондукторный пакет LIMMA 74 v3.28.21. LIMMA — это пакет, разработанный для вызова дифференциально экспрессируемых генов для микрочипов, но он также был адаптирован для секвенирования данных с помощью функции LOOM. LIMMA использовалась для вызова дифференциального обогащения между каждым сравнением смежных стадий (например, E11,5 против E12,5, E12,5 против E13,5 и т. Д.). P Значения были рассчитаны с помощью функции eBayes в LIMMA с отключенным параметром тренда и скорректированы с использованием метода Бенджамини – Хохберга. Бин назывался общей динамикой, если его скорректированное значение P было меньше 0.05 на любом смежном этапе сравнения; в противном случае его называли нединамической корзиной. Нединамические ячейки не были включены в следующий анализ для уменьшения шума. Мы выполнили кластеризацию k -means на динамических ячейках по этапам. Строки (интервалы) были нормализованы путем деления на общее значение таким образом, чтобы сумма квадратов значений равнялась 1. Оптимальный k был определен с использованием метода изгиба для отсечения на значении k , где процент «внутренности» значения переходят от быстрого увеличения к неуклонному увеличению с увеличением k .Результирующие тепловые карты кластеров k -means показаны на рис. 4a и расширенных данных на рис. 16. Для каждого из идентифицированных кластеров мы выполнили тестирование обогащения биологических процессов GO с использованием GREAT. Перепредставленные мотивы для каждого динамического кластера были идентифицированы следующим образом: сначала все матрицы весовых коэффициентов позиции мотивов позвоночных (PWM) были загружены из базы данных JASPAR TF и использованы для сканирования интервалов пиков на наличие мотивов с помощью FIMO, MEME suite v4.11.2. 75 . Для каждого мотива мы вычислили отношение шансов и значимость обогащения в каждом кластере, сравнивая с нединамическим пулом бинов, используя точный критерий Фишера.Из пула нединамических бинов была произведена выборка с заменой, чтобы соответствовать распределению средней мощности сигнала от динамических бинов. После этого значимые TF PWM были сгруппированы в подсемейства с использованием структурной информации из TFClass 71 , потому что они имеют схожие, если не идентичные, связывающие мотивы. Сообщалось о наиболее широко представленных ТФ и связанных с ними подсемействах.
Идентификация суперэнхансеров
Суперэнхансеры идентифицировали с использованием rose v0.1 76,77 с параметрами по умолчанию для каждой стадии ткани с сигналами h4K27ac. Затем супер-энхансеры были объединены в одной и той же ткани и во всех тканях для создания неизбыточного набора супер-энхансеров (расширенные данные, рис. 14c, дополнительная таблица 6).
Ограниченная TAD карта ассоциаций энхансер-промотор
Создание карты
Воспроизводимые вызовы сильных энхансеров (состояние № 5) были объединены с помощью утилиты mergeBed из BEDTools v2.17.0. После этого те регионы или подобласти, которые перекрывали интервалы ± 2.5 т.п.н. из TSS генов в Gencode были исключены из объединенных регионов с помощью subtractBed из BEDTools v2.17.0. Области меньше 2 кб были увеличены до 2 кб от их центральной координаты (чтобы обеспечить более надежную оценку сигнала). В результате получено 66 556 предполагаемых энхансеров. Сигналы h4K27ac в этих областях затем были количественно определены с использованием однозначно выровненных, дедуплицированных считываний. Эти измерения были выполнены с использованием утилиты покрытияBed из BEDTools v2.17.0, затем нормализованы до RPKM в соответствии с глубиной секвенирования каждого образца и преобразованы log 2 (нули были заменены наименьшим обнаруживаемым значением больше нуля).Экспрессия мРНК генов, кодирующих белок, отслеживалась в 66 образцах. Малые и некодирующие РНК исключались из любого последующего шага, рассматривая только те гены с биотипом GENCODE, поддерживающим белок-кодирующие функции. FPKM были преобразованы в log 2 (нули были заменены наименьшим обнаруживаемым значением больше нуля). Для каждого TAD, определенного в геноме мышиных ES-клеток 45 , были извлечены предполагаемые энхансеры и гены. Затем все пары энхансер-ген в TAD оценивали с точки зрения SCC между паттерном обогащения h4K27ac и экспрессией мРНК в образцах.Каждый ген был отнесен к предполагаемому энхансеру, показывающему наивысшее значение SCC. Чтобы привязать P значений к этим корреляциям, нулевое распределение было оценено эмпирически путем расчета SCC энхансера со всеми генами на хромосоме. Для оценки значения P использовались две стратегии: 1) оценка z была рассчитана путем вычитания среднего и деления на стандартное отклонение нуля, а затем соответствующее значение P было рассчитано с использованием функции pnorm в R; 2) эмпирическое значение P было определено как количество раз, когда равный или лучший, чем наблюдаемый SCC, был обнаружен в нуле.Были сохранены только те предполагаемые энхансеры, у которых значение P ≤ 0,05 (для обеих стратегий) и SCC ≥ 0,25. Две карты были независимо получены из двух биологических повторов. Только эти перекрывающиеся ассоциации использовались для дальнейшей оценки и анализа.
Проверка карты энхансер-ген с использованием опубликованных данных о конформации хроматина.
Данные взаимодействия Capture-C в развивающейся конечности и головном мозге 48 были получены из GEO (GSE84792).Анализ взаимодействия хроматина с помощью секвенирования парных концевых меток (ChIA-PET). Взаимодействия в сайтах, связанных с субъединицей когезии SMC1A в развивающейся конечности 49 были взяты из Supplementary Table 2 исходной публикации. Контакты энхансер-ген в клетках печени плода, как предполагалось из Capture HiC 50 , были загружены с ArrayExpress (E-MTAB-2414). Во всех случаях координаты mm9 были сопоставлены с mm10 с помощью программы liftOver. Для каждого опубликованного набора данных сохранялись только те регионы на карте энхансер-ген, которые перекрывали любое экспериментально подтвержденное взаимодействие.Затем рассчитывалась доля взаимодействий, показывающих экспериментальную поддержку, как для гена, назначенного корреляцией, так и для ближайшего гена RefSeq.
Сопоставление карты генов энхансера мыши с человеческим
Предполагаемые области энхансера были картированы в геном человека (hg19) с помощью liftOver со стратегией, аналогичной предыдущим отчетам 78 . Каждая область требовалась как для однозначного сопоставления с hg19, так и для однозначного сопоставления с исходной областью в мм10, с требованием, чтобы ≥50% оснований в каждой области были сопоставлены с мышью после сопоставления с человеком.Для каждой пары энхансер-ген ортологичный ген человека был выведен с использованием BioMart 79 (Ensembl version 87; из http://www.ensembl.org/biomart/martview, Фильтры -> Сравнение нескольких видов -> Атрибуты -> Гомологи -> Мышиные ортологи). Ортологичные пары также должны были иметь одинаковый TAD у человека (TAD, происходящие из человеческих ES-клеток 45 ). Три тысячи пятьсот семьдесят генов на нашей карте мышей имели человеческий ортолог (ген) и по крайней мере один связанный энхансер с выравниваемой областью в человеческом геноме (находящейся в том же человеческом TAD).Из 17 689 предполагаемых энхансеров, которые были успешно картированы на hg19, 12564 были отнесены к генам с однозначным гомологом у человека.
Проверка карты энхансер-ген с использованием опубликованных ассоциаций eQTL-генов.
Однотканевые ассоциации eQTL-ген, созданные консорциумом GTEx. 80 были загружены с портала GTEx (http://gtexportal.org, release v6p) . Учитывались только ткани с более чем 750 000 аннотированных eQTL. Был создан контрольный набор ассоциаций энхансер-ген, соответствующий размеру и распределению TSS-расстояний реальной карты энхансер-ген.Вкратце, для каждой пары энхансер-ген вычислялось расстояние между TSS гена и центральной координатой энхансера; после этого область такого же размера энхансера с центром на том же расстоянии от TSS гена, но на противоположной стороне энхансера была выбрана в качестве контрольного набора. Для анализа eQTL затем была рассчитана доля eQTL, поддерживаемых парами энхансер-ген для десяти интервалов одинакового размера на основе расстояния между энхансером и TSS гена.Та же процедура была применена к ближайшему гену. Затем была рассчитана доля ассоциаций, поддерживаемых eQTL, отдельно для двух групп и для каждой из десяти интервалов. Эти числа были использованы для получения значения P для каждого бина с использованием точного критерия Фишера. Для этого анализа мы рассмотрели только те eQTL, полученные из тканей человека, для которых в этом исследовании был составлен профиль эквивалентной ткани (мозг, сердце, печень, легкие, желудок и тонкий кишечник).
Сравнения с общедоступными картами ассоциаций энхансер-ген
Наборы данных из исх. 6 , GeneHancer 81 , JEME 82 и RIPPLE 83 были загружены и последовательно повторно картированы в геном hg19 с помощью liftOver. Картирование ассоциаций энхансер-ген между разными картами было выполнено с помощью closestBed из BEDTools v2.17.0.
Анализы трансгенных репортеров
Перспективное тестирование элементов
Названия функционально проверенных энхансеров, используемых в данной работе (числа в мм), являются уникальными идентификаторами из браузера VISTA Enhancer (https: //hancer.lbl.gov/) 34 . Энхансеры были выбраны для тестирования следующим образом: пиковые вызовы h4K27ac для трех тканей (сердце E12.5, передний мозг и конечность) были взяты из TSS-дистальных пиков h4K27ac, вызванных с помощью конвейера унифицированной обработки (минимум 10 мм) с помощью ENCODE DCC. (узкие пики из объединенных повторов). Пики для каждой ткани ранжировали по шкале обогащения (от наиболее значимого до наименее значимого). Затем мы выбрали для тестирования предсказанные энхансеры из трех различных групп в ранжированном списке каждой ткани (группы приблизительно были рангами 1–85, 1 500–1550 и 3 000–3050).Локусы, которые уже были включены в обозреватель VISTA Enhancer Browser или которые перекрывали неаннотированные промоторы, были исключены из тестирования. Всего было протестировано 150 предсказанных энхансеров, в том числе 60 кандидатов с самым высоким рейтингом (20 на ткань), 45 со средним рейтингом (15 на ткань) и 45 кандидатов с более низким рейтингом (15 на ткань). Анализы трансгенных мышей проводили на мышах линии FVB / NCrl (Charles River), как описано ранее 52,84 . Вкратце, предсказанные энхансеры были амплифицированы с помощью ПЦР и клонированы в плазмиду перед минимальным промотором Hsp68 и репортерным геном lacZ .Трансгенные эмбрионы получали путем инъекции полученных плазмид в оплодотворенные яйца мыши в пронуклеус. Эмбрионы имплантировали суррогатным матерям, собирали на E12.5 и окрашивали на активность β-галактозидазы. Элементы оценивались как положительные усилители, если по крайней мере три эмбриона имели идентичное окрашивание β-галактозидазой в одной и той же ткани. Элементы оценивались как отрицательные, если не наблюдалось воспроизводимого окрашивания и были получены по меньшей мере пять эмбрионов, несущих вставку трансгена. Геномные координаты и результаты для каждого элемента представлены в дополнительной таблице 10 через портал данных проекта ENCODE (https: // www.encodeproject.org/) и на веб-сайте браузера VISTA Enhancer (https://enhancer.lbl.gov/).
Ретроспективный анализ элементов VISTA
Всего было рассмотрено 422, 299 и 414 элементов, показывающих активность в переднем мозге, конечностях или сердце, соответственно. Для каждого ранжированного списка областей h4K27ac рассчитывали перекрытие с положительными (те элементы, которые проявляют активность в той же ткани, из которой был получен профиль h4K27ac) и отрицательными (во всех тканях или положительными в других тканях) элементами.Сплайн использовался для согласования перекрытия (значения 0–1) с рангом (функция smooth.spline R, степени свободы (df) = 2) отдельно для каждой из трех тканей. Чтобы получить оценки фоновых показателей валидации для каждой ткани, были использованы элементы VISTA, пропущенные профилями h4K27ac. В частности, количество элементов VISTA, проверенных в ткани и части этого набора, было разделено на общее количество элементов VISTA в этом наборе. Уровни валидации для ранжированных элементов VISTA переднего мозга были получены с использованием сплайнового подхода, описанного выше.Каждый элемент был аннотирован с указанием наилучшего перекрывающегося признака (с точки зрения сигнала или оценки LOD консервативного элемента) для каждой из следующих категорий: обогащение h4K27ac, связывание p300, гиперчувствительные сайты к ДНКазе (DHS), сохранение ATAC и phastCons. . Когда они были доступны, биологические реплики использовались для получения отдельных рангов, затем сумма рангов по ним использовалась для повторного ранжирования элементов. DHS были загружены с веб-сайта ENCODE DCC (доступ: ENCSR014SFF) или GEO (доступ: GSM348064, GSM348066, GSM559652).Консервированные элементы PhastCons были загружены из браузера генома UCSC 24 января 2018 г. (phastConsElements60way и phastConsElements60wayPlacental) 85 .
Сопоставление с повторяющимися семействами элементов
Поскольку конвейер анализа ENCODE был ориентирован в первую очередь на однозначно сопоставленные чтения, мы использовали отдельный подход для изучения повторяющихся областей. В частности, мы использовали конвейер с двумя этапами сопоставления для повторной обработки всех файлов fastq. В первом раунде картирования считанные образцы были сопоставлены с эталонным геномом mm10 с использованием Bowtie с: bowtie hg19 -p 16 -t -m 1 -S – chunkmbs 512 – max multimap.fastq input.fastq output.sam 86 . –Max используется для разделения сопоставления считываний с несколькими участками генома от однозначно сопоставленных считываний. Во втором раунде картирования был создан настраиваемый файл сборок путем конкатенации геномных экземпляров каждого подсемейства повторяющихся элементов, их фланкирующих геномных последовательностей длиной 15 п.н. и спейсерной последовательности 200 п.н. в формате FASTA 87 . Файл аннотации для повторяющихся элементов, используемый на этом этапе, был загружен с Repeatmasker.org. Сценарий python использовался со следующими параметрами: python RepEnrich.py /data/mm10_repeatmasker.txt / data / sample_A sample_A / data / mm10_setup_folder sampleA_multimap.fastq sampleA_unique.bam – cpus 16 88 . Количество операций чтения, сопоставленных подсемействам повторяющихся элементов, семействам повторяющихся элементов или классам повторяющихся элементов, было определено с использованием информации как из однозначно сопоставленных считываний, которые перекрываются с повторяющимся элементом, так и из не уникально сопоставленных операций чтения. Поскольку некоторые из подсемейств повторяющихся элементов очень похожи друг на друга, для классификации считываний, отображаемых на несколько подсемейств повторяющихся элементов, использовался метод дробного подсчета.Он суммирует считывания, которые однозначно отображаются на подсемейство повторяющихся элементов, и подсчитывает считывания, которые отображаются на несколько подсемейств с использованием дроби 1/ n s , где n s — это количество подсемейств повторяющихся элементов, с которыми читать выравнивает. Таблица подсчетов, которые оценивают сигнал обогащения для классов повторов в разных тканях, строится как окончательный результат для построения графиков.
Обработка данных в R
Большинство описанных этапов обработки данных (построение графиков, статистические тесты, вычисление корреляций и иерархическая кластеризация) выполнялись в среде статистических вычислений R v.3.3.1 (https://www.r-project.org/).
Сводка отчетов
Дополнительная информация о дизайне исследований доступна в Сводке отчетов по исследованиям природы, связанной с этим документом.
Пренатальное развитие | Безграничная психология
Роль генов в пренатальном развитии
Пренатальное развитие сильно зависит от наследования, экспрессии и регуляции генов.
Цели обучения
Объясните важность генетики в пренатальном развитии
Ключевые выводы
Ключевые моменты
- Пренатальное развитие — это процесс, который происходит в течение 40 недель до рождения ребенка и в значительной степени зависит от генетики.
- Каждый человек состоит из клеток, содержащих хромосомы, которые представляют собой генетический материал, который определяет многие вещи в человеке, такие как цвет глаз и волос, биологический пол и личностные черты.
- Экспрессия генов в организмах тщательно регулируется, чтобы позволить организмам адаптироваться к различным условиям. Гены могут быть доминантными или рецессивными, что означает, что они могут быть как выраженными, так и скрытыми.
- Генная регуляция — это процесс, посредством которого клетки дифференцируются: в то время как одни клетки развиваются в клетки мозга, другие развиваются в клетки печени, клетки кишечника или половые репродуктивные органы.
Ключевые термины
- дезоксирибонуклеиновая кислота : генетический компонент, обнаруженный во всех живых существах, который связан с передачей генетической информации; состоит из полимера, образованного нуклеотидами, имеющими форму двойной спирали.
- хромосома : структура в ядре клетки, содержащая ДНК, гистоновый белок и другие структурные белки.
- зачатие : Оплодотворение яйцеклетки спермой с образованием зиготы.
- зигота : оплодотворенная яйцеклетка.
Пренатальное развитие
Психологи, занимающиеся вопросами развития, рассматривают процесс человеческого развития в его связи с физическим, когнитивным и психосоциальным развитием. Это развитие продолжительности жизни подразделяется на разные стадии в зависимости от возраста. Пренатальное развитие — это процесс, который происходит в течение 40 недель до рождения ребенка и во многом зависит от генетики.
Существует три стадии пренатального развития — зародышевый, эмбриональный, и плодный .Пренатальное развитие также разделено на триместры: первый триместр заканчивается окончанием эмбриональной стадии, второй триместр заканчивается на 20 неделе, а третий триместр заканчивается при рождении.
Обзор генетического наследования
Хромосомы
Каждый человек состоит из клеток, каждая из которых содержит хромосомы. Хромосомы — это генетический материал, который определяет многое в человеке, например цвет глаз и волос, биологический пол и личностные черты. ДНК, или дезоксирибонуклеиновая кислота, отвечает за передачу генетического материала.ДНК матери и отца передается в момент зачатия.
ДНК : ДНК представляет собой лестничную структуру, содержащую генетический материал.
Всего у человека 23 пары хромосом. Развивающаяся зигота получает половину хромосом от одного родителя и половину от другого родителя. Первые 22 пары хромосом известны как аутосомы и определяют такие вещи, как цвет глаз и волос. Последняя пара, известная как половые хромосомы, определяет биологический пол человека: у женщин есть две X-хромосомы, а у мужчин — X и Y-хромосомы.
Экспрессия гена и регулирование
Экспрессия генов тщательно регулируется в каждом организме, чтобы позволить организму адаптироваться к различным условиям. Выражение генетической информации в данной клетке или организме не является ни случайным, ни полностью заранее запрограммированным. Гены могут быть доминантными или рецессивными, что означает, что они могут быть как выраженными, так и скрытыми. В зависимости от доминирования каждой хромосомы, унаследованной от каждого родителя, ребенок может проявлять или не проявлять унаследованный признак.
Генная регуляция — это процесс дифференциации клеток. Среди прочего, это процесс, в котором клетка определяет, какие гены она будет экспрессировать и когда. Дифференциация клеток — это процесс, при котором менее специализированная клетка становится более специализированной клеткой. Например, по мере развития зиготы регуляция генов превращает одни клетки в клетки мозга, а другие — в клетки печени. Другие клетки станут оболочкой желудка, кишечника и половых репродуктивных органов.
Мутация — это внезапное изменение сегмента ДНК.Некоторые мутации генов могут вызывать такие состояния, как синдром Дауна или синдром Тернера.
Важность генетики в развитии человека
Различия в экспрессии генов — будь то в результате стандартных процессов регуляции или в результате мутации — имеют решающее значение для физического и психологического развития человека. Точная степень, в которой гены, в отличие от окружающей среды человека, определяют или влияют на психологическое развитие, горячо обсуждается; это противоречие известно как «природа против.- дебаты о воспитании ». Однако генетический состав человека, по крайней мере, служит решающим исходным уровнем (который затем может быть опосредован окружающей средой) для таких характеристик, как способность начать изучение разговорной речи, таких личностных черт, как склонность к агрессивному поведению по сравнению с покорным, и уровни риска таких заболеваний, как алкоголизм и наркомания.
Перед рождением плод, конечно, имел ограниченные возможности формироваться под воздействием окружающей среды, помимо таких факторов, как диета матери, употребление психоактивных веществ и уровень беспокойства.По этой причине генетика играет особенно важную роль в пренатальном развитии.
Пренатальное развитие мозга
Пренатальное развитие — это процесс быстрых изменений и роста, который происходит за 40 недель до рождения ребенка.
Цели обучения
Обзор основных этапов пренатального развития мозга
Ключевые выводы
Ключевые моменты
- Существует три стадии пренатального развития: зародышевый, эмбриональный и фетальный.Пренатальное развитие также разделено на три равных триместра, которые не соответствуют трем этапам.
- Зародышевый этап происходит от зачатия до 2 недель (имплантация), в течение которых зигота начинает быстро делиться.
- Эмбриональная стадия длится от имплантации (2 недели) до 8-й недели беременности. На этом этапе происходит быстрый рост и развиваются системы органов.
- Стадия плода длится с 9 недели до рождения ребенка (обычно от 38 до 40 недель).На этом этапе мозг продолжает расти и развиваться быстрыми темпами.
Ключевые термины
- зигота : оплодотворенная яйцеклетка.
- эмбрион : организм на ранних стадиях развития; у человека обычно происходит рост клеток до конца седьмой недели внутриутробного развития.
- нервная трубка : полая продольная дорсальная трубка, образованная при складывании и последующем слиянии противоположных эктодермальных складок в эмбрионе, которая дает начало головному и спинному мозгу.
- оплодотворение : Оплодотворение гамет животных или растений.
Пренатальное развитие — это процесс, который происходит в течение 40 недель до рождения ребенка. Выделяют три стадии пренатального развития: зародышевый , эмбриональный, и плодный . Пренатальное развитие также разделено на три равных триместра, которые не соответствуют трем этапам. Первый триместр заканчивается окончанием эмбриональной стадии, второй триместр заканчивается на 20 неделе, а третий триместр заканчивается при рождении.
Зародышевый этап
Зародышевый этап — это этап развития, который происходит от зачатия до 2 недель (имплантация). Зачатие происходит, когда сперматозоид оплодотворяет яйцеклетку и образует зиготу. Зигота начинается как одноклеточная структура, которая создается при слиянии сперматозоидов и яйцеклетки. В момент зачатия ДНК матери и отца передается; генетический состав и пол будущего плода устанавливаются на этом этапе. В течение первой недели после зачатия зигота быстро делится и размножается, переходя от одноклеточной структуры к двухклеточной, затем к четырем, затем к восьми клеткам и так далее.Этот процесс деления клеток называется митоз . Митоз — это хрупкий процесс, и менее половины всех зигот выживают после первых двух недель (Hall, 2004). Через 5 дней митоза насчитывается 100 клеток, а через 9 месяцев — миллиарды клеток. По мере деления клетки становятся более специализированными, образуя разные органы и части тела. На стадии зародыша клетки, необходимые для плаценты, пуповины и околоплодных вод, дифференцируются, чтобы сформировать эмбрион.Масса клеток еще не прикрепилась к слизистой оболочке матки; как только эта привязанность возникает, начинается следующий этап.
Эмбрион : Во время зародышевой стадии пренатального развития клетки, необходимые для плаценты, пуповины и околоплодных вод, дифференцируются с образованием эмбриона.
Эмбриональная стадия
Эмбриональная стадия длится от имплантации (2 недели) до 8 недели беременности. После того, как зигота делится примерно на 7–10 дней и насчитывает 150 клеток, она перемещается по фаллопиевым трубам и имплантируется в слизистую оболочку матки.После имплантации этот многоклеточный организм называется эмбрионом. Теперь кровеносные сосуды разрастаются, образуя плаценту. Плацента — это структура, соединенная с маткой, которая обеспечивает питание и кислород от тела женщины к развивающемуся эмбриону через пуповину.
В течение первой недели эмбрионального периода эмбриональный диск разделяется на три слоя: эктодерма , мезодерма, и энтодерма. Эктодерма — это слой, который станет нервной системой и внешними слоями кожи; мезодерма станет кровеносной системой, скелетом, мышцами, репродуктивной системой и внутренним слоем кожи; и энтодерма станет дыхательной системой и частью пищеварительной системы, а также мочевыводящих путей.
Первой развивающейся частью эмбриона является нервная трубка, которая станет спинным и головным мозгом. Когда нервная система начинает развиваться, крошечное сердечко начинает перекачивать кровь, и начинают появляться другие части тела, такие как пищеварительный тракт и позвоночник. Во второй половине этого периода рост идет очень быстрыми темпами. Развиваются глаза, уши, нос и челюсть; сердце развивает камеры; и кишечник растет.
Стадия плода
Остальная часть пренатального развития происходит на стадии плода, которая длится с 9 недели до рождения (обычно между 38 и 40 неделями).Когда организму исполняется около девяти недель, эмбрион называют плодом. На этом этапе плод размером с фасоль и начинает принимать узнаваемую форму человека. Между 9 и 12 неделями начинают появляться рефлексы, и рука и ноги начинают двигаться (однако эти первые движения не будут ощущаться в течение нескольких недель). В это же время начинают дифференцироваться половые органы. Примерно в 16 недель длина плода составляет примерно 4,5 дюйма. Пальцы рук и ног полностью развиты, на них видны отпечатки пальцев.К тому времени, когда плод достигает шестого месяца развития (24 недели), он весит до 1,4 фунта. Развился слух, поэтому плод может реагировать на звуки. Внутренние органы, включая легкие, сердце, желудок и кишечник, сформировались достаточно, чтобы плод, рожденный преждевременно на этом этапе, имел шанс выжить за пределами матки.
Стадии развития : На стадии зародыша мозг развивается, и тело увеличивается в размерах и весе, пока плод не достигнет полноценного развития.
На протяжении всей внутриутробной стадии мозг продолжает расти и развиваться, увеличиваясь почти вдвое с 16 по 28 неделю. Рост мозга в этот период позволяет плоду развить новое поведение. Кора головного мозга увеличивается в размерах, и плод проводит больше часов в бодрствующем состоянии. Плод движется с большей координацией, что указывает на большее количество нейронных связей в головном мозге. Нервная система контролирует больше функций организма, и даже личность начинает проявляться в утробе матери. К 28 неделям формируются таламические мозговые связи, которые опосредуют сенсорную информацию.Плод может различать голоса и запоминать песни и определенные звуки после рождения. Плод также становится чувствительным к свету; на самом деле, если врач направит свет на матку, ребенок попытается прикрыть глаза. Рост начинает замедляться примерно на 30-32 неделе, но небольшие изменения продолжаются до рождения.
Примерно через 36 недель плод почти готов к рождению. Он весит около 6 фунтов и имеет длину около 18,5 дюймов, и к 37 неделе все системы органов плода достаточно развиты, чтобы он мог выжить за пределами матки без многих рисков, связанных с преждевременными родами.Плод продолжает набирать вес и расти в длину примерно до 40 недель. К тому времени у плода остается очень мало места для движения, и рождение становится неизбежным.
Хронология пренатального развития : На этой диаграмме подробно описывается пренатальное развитие от зачатия до рождения.
Воздействие окружающей среды на внутриутробное развитие
Факторы окружающей среды, такие как воздействие тератогенов, могут иметь ряд воздействий на развивающийся плод.
Цели обучения
Обсудить влияние тератогенов и материнского стресса на пренатальное развитие
Ключевые выводы
Ключевые моменты
- Во время внутриутробного развития факторы окружающей среды могут существенно повлиять на развитие ребенка.
- Почти все, что глотает мать, включая пищу, жидкость и даже лекарства, проходит через плаценту к плоду; все, что мать подвергается воздействию окружающей среды, влияет на плод.
- Тератоген — это любое вещество или агент в окружающей среде, который может оказывать вредное воздействие на развивающийся плод. Различные тератогены включают наркотики, алкоголь, табак и другие агенты окружающей среды.
- Неблагоприятные эффекты тератогена зависят от нескольких факторов, таких как доза или уровень воздействия, наследственность, возраст тератогена и любые другие негативные факторы.
- Любая форма пренатального стресса, испытываемого матерью, может отрицательно сказаться на различных аспектах развития плода; когда мать находится в состоянии стресса, в организме происходят физиологические изменения, которые могут нанести вред развивающемуся плоду.
Ключевые термины
- синдром внезапной детской смерти : внезапная и необъяснимая смерть младенца в возрасте от одного месяца до одного года, обычно во время сна.
- алкогольный синдром плода : Любой из ряда врожденных дефектов, возникающих в результате чрезмерного употребления алкоголя матерью во время беременности.
- тератоген : Любой агент или вещество, которое может вызвать уродство эмбриона или врожденные дефекты.
- зигота : оплодотворенная яйцеклетка.
- плацента : сосудистый орган млекопитающих, присутствующий только у самок во время беременности, доставляющий пищу и кислород от матери к плоду и отводящий отходы обратно.
Пренатальное развитие — это процесс, который происходит в течение 40 недель до рождения ребенка. На каждом внутриутробном этапе факторы окружающей среды влияют на развитие плода.Развивающийся плод полностью зависит от матери на всю жизнь, и важно, чтобы мать получала пренатальную помощь, то есть медицинскую помощь во время беременности, которая контролирует здоровье как матери, так и плода. По данным Национального института здоровья ([NIH], 2013), регулярная дородовая помощь может снизить риск осложнений для матери и плода во время беременности.
Когда зигота прикрепляется к стенке матки, образуется плацента. Плацента обеспечивает плод питанием и кислородом.Почти все, что глотает мать, включая пищу, жидкость и даже лекарства, проходит через плаценту к плоду — отсюда распространенная фраза, что мать «ест за двоих». Все, что мать подвергается воздействию окружающей среды, влияет на плод; если мать подвергается воздействию чего-то вредного, у ребенка могут проявляться пожизненные последствия.
Тератогены
Тератоген — это любое вещество или агент окружающей среды — биологический, химический или физический — который может оказывать пагубное воздействие на развивающийся плод.Воздействие тератогенов на пренатальном этапе может значительно повысить риск врожденных дефектов. На количество повреждений, которые может нанести тератоген, влияют несколько факторов, включая дозу или уровень воздействия, наследственность, возраст тератогена и любые другие негативные воздействия (например, несколько тератогенов или тератоген в сочетании с плохим здоровьем). Существует несколько известных тератогенов, которых беременным женщинам рекомендуется избегать во время беременности, включая алкоголь, отпускаемые по рецепту и / или запрещенные препараты, а также табак.
Спирт
Алкоголь и большинство наркотиков проникают через плаценту и влияют на плод. Было обнаружено, что употребление алкоголя во время беременности является основной предотвратимой причиной психических расстройств у детей в Соединенных Штатах (Maier & West, 2001). Чрезмерное употребление алкоголя матерью во время беременности может вызвать расстройства алкогольного спектра плода (ФАСН) с пожизненными последствиями для ребенка, степень тяжести которых варьируется от незначительной до серьезной. Неизвестно, сколько алкоголя необходимо, чтобы вызвать повреждение, поэтому врачи обычно рекомендуют полностью избегать употребления алкоголя во время беременности.Физически дети с ФАСН могут иметь небольшой размер головы и аномальные черты лица. В когнитивном плане у этих детей могут быть плохие суждения, плохой контроль над импульсами, более высокие показатели СДВГ и проблем с обучением, а также более низкие показатели IQ. Эти проблемы и задержки в развитии сохраняются и во взрослой жизни (Streissguth et al., 2004). На основании исследований, проведенных на животных, также было высказано предположение, что употребление алкоголя матерью во время беременности может предрасполагать ее ребенка к алкоголю (Youngentob et al., 2007).
Расстройство алкогольного спектра у плода : Симптомы ФАСН включают медленный физический рост, аномальные черты лица (такие как гладкий желобок или отсутствие вмятин на верхней губе) и травмы головного мозга.
Каждый орган плода развивается в течение определенного периода беременности, называемого критическим или чувствительным периодом . Исследования ФАСН показали, что время, в течение которого развивающийся плод подвергается воздействию алкоголя, может резко повлиять на внешний вид черт лица, связанных с ФАСН.В частности, это исследование предполагает, что воздействие алкоголя, ограниченное 19 или 20 днем беременности, может привести к значительным лицевым аномалиям у потомства приматов (Ashley, Magnuson, Omnell, & Clarren, 1999). В данных областях мозга также наблюдаются чувствительные периоды, в течение которых они наиболее восприимчивы к тератогенным эффектам алкоголя (Tran & Kelly, 2003).
Рецептурные и / или запрещенные препараты
Использование любого типа наркотиков — незаконных, отпускаемых по рецепту или без рецепта — может быть опасным во время беременности.Незаконные наркотики, такие как героин, кокаин и метамфетамин, могут вызвать множество проблем для развивающегося плода: дети могут рождаться зависимыми от определенных наркотиков, а также с большей вероятностью родиться преждевременно, иметь низкий вес при рождении и испытывать другие физические дефекты. Многие в конечном итоге сталкиваются с проблемами внимания и поведением.
Рецептурные препараты, принимаемые во время беременности, такие как стрептомицин, тетрациклин, некоторые антидепрессанты, прогестин, синтетический эстроген, аккутан, талидомид и диэтилстильбестрол (известный как DES), а также отпускаемые без рецепта лекарства, такие как таблетки для похудания, также могут вызывать тератогенные исходы для развивающегося плода.Талидомид вызывает уродства тела, а также повреждение внутренних органов. Было показано, что у плодов, подвергшихся воздействию DES, выше уровень рака и бесплодия во взрослом возрасте. Кроме того, известно, что высокие дозы аспирина вызывают кровотечение у матери и плода, хотя низкие дозы аспирина обычно не вредны. Классификация лекарств (как A, B, C, D, или X ) позволяет матери принимать решение об употреблении наркотиков во время беременности: например, препараты класса A всегда считаются безопасными, тогда как класс Доказано, что препараты X наносят вред плоду.
Курение
Курительный табак также считается тератогеном, потому что никотин попадает через плаценту к плоду. Когда мать курит, у развивающегося ребенка снижается уровень кислорода в крови. По данным Центров по контролю и профилактике заболеваний (2013 г.), курение во время беременности может привести к преждевременным родам, рождению детей с низкой массой тела, мертворождению и синдрому внезапной детской смерти (СВДС) — внезапной и необъяснимой смерти ребенка младше 10 лет. годовалый возраст.Другими проблемами, которые могут быть вызваны пренатальным воздействием курения, являются невнимательность, мышечное напряжение и колики (форма боли, которая начинается и прекращается внезапно и возникает из-за мышечных сокращений в теле). Чем больше мать курит или подвергается воздействию вторичного табачного дыма, тем выше риск; однако отказ от курения (даже после курения во время беременности) значительно снижает риск возникновения этих проблем.
Другие тератогены
Другие тератогены, влияющие на пренатальное развитие, включают радиацию, загрязнение окружающей среды и инфекционные заболевания.Радиация увеличивает риск рака у детей, а также эмоциональных и поведенческих расстройств; по этой причине беременным женщинам рекомендуется избегать рентгеновского облучения без крайней необходимости. Загрязнение, такое как воздействие ртути или ПХБ, может вызвать физические деформации, нарушение речи и проблемы с координацией. Материнские инфекции, такие как вирусы или паразиты, также могут вызвать повреждение мозга плода или даже смерть.
Ребенок в отделении интенсивной терапии новорожденных : Воздействие тератогенов во время беременности может вызвать множество проблем для развивающегося плода и новорожденного.
Материнский стресс и депрессия
Любая форма пренатального стресса, испытываемого матерью, может отрицательно сказаться на различных аспектах внутриутробного развития плода и причинить вред как матери, так и ребенку. Когда мать находится в состоянии стресса, в организме происходят физиологические изменения, которые могут нанести вред развивающемуся плоду. Кроме того, мать, находящаяся в стрессовом состоянии, более склонна к поведению, которое может негативно повлиять на плод, например, к курению, употреблению наркотиков и алкоголю. Пренатальная депрессия часто вызывается стрессом и беспокойством, которые может принести беременность, но только в более тяжелой форме.Другие факторы, которые могут подвергнуть человека риску пренатальной депрессии, включают незапланированную беременность, трудности с беременностью, жестокое обращение в анамнезе, а также экономические или семейные проблемы.
Упомянутое выше употребление антидепрессантов во время беременности связано с множеством рисков для плода с разной степенью доказательства причинно-следственной связи. В то время как одни исследования ясно показывают неблагоприятные исходы пренатального воздействия антидепрессантов, другие менее очевидны — и возникают осложнения, потому что депрессия сама по себе независимо связана с отрицательными исходами беременности.Трудно определить степень, в которой неблагоприятные исходы вызваны употреблением антидепрессантов или депрессией — или их комбинацией; Также важно учитывать негативные последствия отказа матери во время беременности от антидепрессантов, которые могут иным образом повлиять на ее здоровье.
Развитие плода — как растет ваш ребенок во время беременности
Информация о здоровье
Ваш цикл
Здоровье 360 °
Забеременеть
Беременность
Быть мамой
Инструменты
Персонализируйте свой Flo
Персонализируйте свой Flo
Поиск
Ваш цикл
- Здоровье
- Секс
- Стиль жизни
- Менопауза
- Полового созревания
Здоровье 360 °
- Болезни
- Симптомы
- Стиль жизни
- Красота
- Душевное здоровье
Забеременеть
- Планирование беременности
- Пытаясь зачать
- Проблемы с зачатием
Беременность
- Здоровье беременности
- Образ жизни при беременности
- Беременность неделя за неделей
- Гнездование
- Роды
- Выбор имени
Быть мамой
- Восстановление с рождения
- Приспосабливаясь к материнству
- Воспитание ребенка
Инструменты
- Калькулятор срока платежа
- Калькулятор срока платежа
- Калькулятор срока родов ЭКО и ФЭТ
- Срок выполнения с помощью ультразвукового калькулятора
Центр помощи
- О нас
- Центр помощи
- Flo для бизнеса
- Сотрудничество
- Новости
- Нажмите
- Наша медицинская экспертиза
- Наши создатели контента
- Редакционный процесс и стандарты
- Твое тело твоя история
- Карьера
- Свяжитесь с нами
Беременность
Здоровье беременности
Развитие плода
Показать больше
- О нас
- Центр помощи
- Flo для бизнеса
- Сотрудничество
- Новости
- Нажмите
- Наша медицинская экспертиза
- Наши создатели контента
- Редакционный процесс и стандарты
- Твое тело твоя история
- Карьера
- Свяжитесь с нами
Политики:
- Безопасность в Flo
- Политика конфиденциальности
- Условия эксплуатации
- Политика использования файлов cookie
- Принципы рекламы
- Правила использования товарных знаков
© 2021 Flo Health, Inc.
